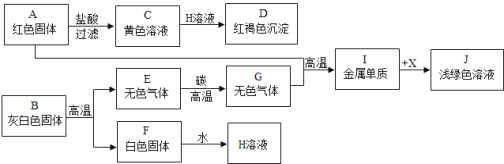
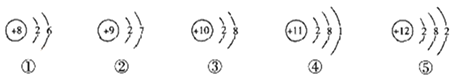
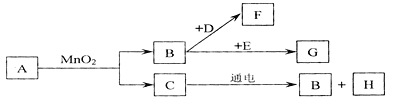
题目内容
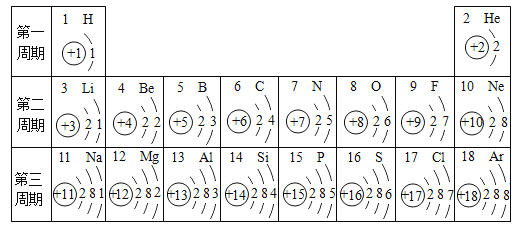
【题目】氢氧化钾是我国古代纺织业常用作漂洗的洗涤剂。古人将贝壳(主要成分是碳酸钙)高温煅烧后的固体与草木灰(主要成分是碳酸钾)在水中相互作用就可制得氢氧化钾。写出与制氢氧化钾有关的化学方程式,并注明反应类型。
(1)________________________________(________)反应
(2)________________________________(________)反应
(3)________________________________(________)反应
【答案】 CaCO3![]() CaO+CO2↑ 分解 CaO+H2O=Ca(OH)2 化合 Ca(OH)2+K2CO3=CaCO3↓+2KOH 复分解
CaO+CO2↑ 分解 CaO+H2O=Ca(OH)2 化合 Ca(OH)2+K2CO3=CaCO3↓+2KOH 复分解
【解析】根据碳酸钙在高温下会分解出氧化钙,氧化钙和水会生成氢氧化钙,氢氧化钙和碳酸钾会发生复分解反应进行分析;根据反应物、生成物的类别判断反应的基本类型。(1)碳酸钙在高温的条件下生成氧化钙和二氧化碳,反应的化学方程式为CaCO3高温CaO+CO2↑;该反应由一种物质反应生成两种物质,符合分解反应的概念,属于分解反应;(2)氧化钙和水反应生成氢氧化钙,反应的化学方程式为CaO+H2O=Ca(OH)2;该反应由两种物质反应生成一种物质,符合化合反应的概念,属于化合反应;(3)氢氧化钙和碳酸钾反应生成碳酸钙沉淀和氢氧化钾,反应的化学方程式为Ca(OH)2+K2CO3=CaCO3↓+2KOH;该反应由两种化合物相互交换成分形成两种新的化合物,符合复分解反应的概念,属于复分解反应。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】为测定某黄铜(铜、锌合金)中铜的质量分数,称取32.5g该黄铜粉末放入烧杯中,再向烧杯内加入200g稀硫酸(足量),每隔10分钟测烧杯内(不含烧杯)剩余物质的质量,测得数据如表:
加入稀硫酸后10分钟 | 加入稀硫酸后20分钟 | 加入稀硫酸后 | 加入稀硫酸后40分钟 | 加入稀硫酸后50分钟 |
232.4g | 232.3g | 232.2g | 232.1g | 232.1g |
(1)完全反应后生成氢气的质量为______g.
(2)计算该黄铜中铜的质量分数为________(写出计算过程).
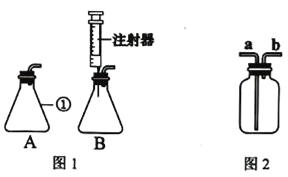
【题目】实验课上,同学们利用如图所示装置进行气体制备。
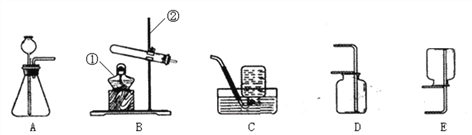
(1)写出图中有标号的仪器的名称:①___________、②__________。
(2)反应原理:实验室用加热高锰酸钾制取氧气的文字表达式为______________。用大理石和稀盐酸制取二氧化碳的文字表达式为____________________。
(3)气体制备:二氧化碳的发生装置是__________(填序号,下同)。
(4)气体的收集:实验室收集氧气的装置可选用___________,选择该收集方法是根据氧气具有_________________的性质。
(5)气体的检验:
气体 | 检验方法 | 实验现象 |
O2 | ______________ | ______________ |
CO2 | ______________ | ______________ |
(6)氨气(NH3)是一种密度比空气小,极易溶于水的气体,实验室可用加热氯化铵和氢氧化钙固体混合物制得氨气。氨气在加热条件下能与氧化铜反应生成铜、水和空气中含量最多的气体。制取氨气应选择_______和________装置连接。请写出氨气和氧化铜(CuO)反应的文字表达式_______________________________。