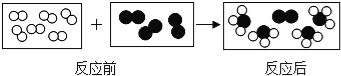
题目内容
【题目】从含FeSO4和CuSO4的废液中回收Cu并制FeSO47H2O实验方案如下:

(1)金属X应选用_______(填序号)。a.Zn b.Cu c.Fe
(2)操作a、b中所用玻璃仪器有:烧杯、_______、玻璃棒。
(3)证明所加稀硫酸过量的方法是:取操作b所获固体,加入__________,无现象。
(4)用加热方法干燥固体,所得Cu不纯,原因是___________(用化学方程式表示)。
上述所制产品中FeSO4质量_______(填“大于”、“小于”或“等于”)原废液中的FeSO4。
【答案】C 漏斗 稀盐酸或稀硫酸或硫酸铜溶液 2Cu+O2![]() 2CuO 大于
2CuO 大于
【解析】
(1)金属X应选用Fe,加入铁时,能和硫酸铜反应生成硫酸亚铁和铜;
(2)操作1、2是过滤,过滤过程中,所用玻璃仪器主要有漏斗、玻璃棒、烧杯等;
(3)加稀硫酸过量的目的是出去剩余的铁,只要证明操作b所获固体中没有铁即可,所以:取操作b所获固体,加入稀盐酸或稀硫酸或硫酸铜溶液,无现象,说明所加稀硫酸过量;
(4)加热过程中铜会与氧气反应生成氧化铜,化学方程式为:2Cu+O2![]() 2CuO;加入过量铁时,能和硫酸铜反应生成硫酸亚铁和铜,剩余的铁又和硫酸反应生成硫酸亚铁,导致产品中FeSO4质量大于废液中的FeSO4。
2CuO;加入过量铁时,能和硫酸铜反应生成硫酸亚铁和铜,剩余的铁又和硫酸反应生成硫酸亚铁,导致产品中FeSO4质量大于废液中的FeSO4。

【题目】小强同学经过查阅资料得知:铝丝和铁丝一样,也能在氧气中燃烧,于是设计了如图所示的装置进行实验探究,请你结合实验过程回答下列问题。
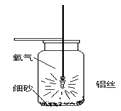
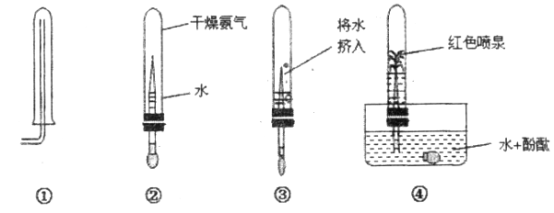
(1)集气瓶底预先铺少量沙子的目的是________。
(2)铝丝下端系一根火柴的目的是:________。
(3)用正确方法引燃铝丝,伸入装有氧气的集气瓶中后,未观察到铝丝发生剧烈燃烧现象,可能的原因是________。
(4)某化学兴趣小组的同学经查阅资料得知:人呼吸中各种气体的体积分数如表所示:
气体 | 吸入气体 | 呼出气体 |
X | 78% | 75% |
Y | 21% | 15% |
二氧化碳 | 0.03% | 3.68% |
水 | 0.02% | 5.44% |
其它 | 0.95% | 0.88% |
①请你判断:表中X是________,Y是________;
②欲证明人呼出的气体中含有水蒸气,其实验方法是___________。
【题目】钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
I.铁的应用
(1)下列铁制品的利用与金属导热性有关的是________(填字母,下同)。
A.铁钳 B.铁锅 C.刀具
(2)“纳米α-Fe粉”可用于食品保鲜,称为“双吸剂”,因为它能吸收空气中的____和_____。
II.铁的冶炼 请回答下列问题:
(1)写出以赤铁矿为原料,在高温下炼铁的化学方程式:______;
(2)高炉炼铁中,焦炭的作用除了可以生成一氧化碳外,还能_______。
Ⅲ.实验探究炼铁原理
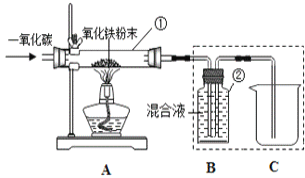
某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究CO与Fe2O3反应后的产物。
(查阅资料):
①草酸(H2C2O4)固体与浓硫酸混合加热会产生一氧化碳,反应方程式为:
H2C2O4 ![]() CO2
CO2![]() +CO
+CO![]() +H
+H![]() O
O
②NaOH溶液可以吸收二氧化碳, ③ 浓硫酸是一种常用的干燥剂。
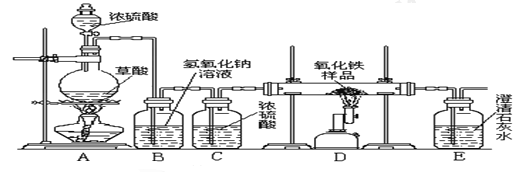
于是他设计了下图的实验装置,结合装置回答下列问题:
(1)图中装置C作用是_______________;
(2)装置E中澄清石灰水的作用是________________,该反应化学方程式为_____________;
(3)从实验操作程序和实验安全看,首先要检查装置的气密性,实验开始先加热__________(填A或D)处。实验结束应先停止加热该处,这样做的目的除了可防止生成的铁被氧化,还可以起到的目的是___________。
(4)该装置设计有一个明显缺陷,你认为是_________。
(5)实验时准确称取一定质量纯净的Fe2O3固体按上图进行实验,当D中固体全部变黑后,停止加热,继续通入CO直到玻璃管冷却。将得到的黑色固体加入到足量的稀盐酸,发现固体全部溶解,但无气泡产生。
(查阅资料):a. 铁的氧化物在足量的稀盐酸中均能全部溶解,但无气泡产生。
b. Fe2O3与CO反应的固体生成物可能情况如下:
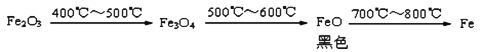
根据“无气泡”猜想,黑色粉末可能是:① Fe3O4 ;②__________ ;③Fe3O4 和Fe O 。
(6)定量分析 用电子天平称量得部分数据如下:
玻璃管质量 | 玻璃管及其中固体的质量 | 装置E及其中物质的总质量 | |
反应前 | 28.20 g | 37.80g | 300.0 g |
反应后 | 37.48 g | 300.8 g |
根据上述数据,纯净的Fe2O3固体质量为_______ g,请选择有效的数据,推断出反应后黑色固体的成分 _____________, 根据推断结果,写出该实验中玻璃管内发生的化学反应方程式:_____________。