题目内容
【题目】无色晶体硫酸锌,俗称皓矾,在医疗上用作收敛剂、工业上作防腐剂、制造白色颜料(锌钡白)等。实验室通常用粗锌(含有铁等杂质)和稀硫酸反应制取氢气。为了充分利用制氢废液,某实验小组用制氢废液为原料制备硫酸锌晶体并探究其性质。
(制备硫酸锌晶体)
已知:①开始生成氢氧化物沉淀到沉淀完全的pH值的范围分别为:Fe(OH)3:2.7—3.7 Fe(OH)2:7.6—9.6 Zn(OH)2:5.7—8
②硫酸锌微溶于酒精
实验流程如图所示:

试回答下列问题:
(1)实验室制取氢气的原理_______ (用化学方程式表示)。
(2)溶液A中加入试剂①的目的是使FeSO4转化为Fe2(SO4)3,通常用过氧化氢溶液,该反应的化学方程式为![]() ,X的化学式为____________。
,X的化学式为____________。
(3)加试剂②的目的是使铁元素完全沉淀,加入试剂②最好选用_________。
A ZnO
B Zn(OH)2
C NaOH
D ZnSO4
(4)结晶操作的过程包括:蒸发浓缩、_________。
(5)最后一次过滤得到的晶体用酒精洗涤晶体而不用水洗的目的是_____。
(测定硫酸锌晶体ZnSO4·xH2O中结晶水的含量)
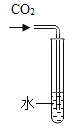
实验小组同学将回收到的皓矾晶体(ZnSO4·xH2O)用下面的装置测定晶体中结晶水的含量(图中半透膜可让气体通过又可防止固体粉末进入导管)。测定方法:称取28.7g晶体置于C装置的硬质玻璃管中,加热至完全失去结晶水:(![]() ),冷却至常温后,称量玻璃管中固体,其质量为16.1g。
),冷却至常温后,称量玻璃管中固体,其质量为16.1g。

(1)A中的化学方程式是_____,B中的试剂可从下列物质中选取,你的选择是_____。
A 浓硫酸
B 硝酸银溶液
C 饱和碳酸钠溶液
D 澄清石灰水
(2)实验过程中若不通入空气测得的结果将_______(填“偏大”或“偏小”或“无影响”)。根据实验结果,计算皓矾晶体中结晶水的x值为____________。(写出计算过程)
【答案】Zn+H2SO4=ZnSO4+H2↑ H2SO4 A B 冷却结晶 防止晶体因溶解于水而损耗(酒精易挥发,更有利于晶体快速干燥) ![]() A 偏小 7
A 偏小 7
【解析】
[制备硫酸锌晶体](1)在实验室中,常用锌和稀硫酸反应制取氢气,同时生成硫酸锌,化学方程式为Zn+H2SO4=ZnSO4+H2↑;故填:Zn+H2SO4=ZnSO4+H2↑;
(2)根据化学方程式2FeSO4+H2O2+X═Fe2(SO4)3+2H2O,根据质量守恒定律可得,反应前铁原子有2个,硫原子2个,氧原子10个,氢原子2个,反应后现有铁原子有2个,硫原子3个,氧原子14个,氢原子4个,所以每个X分子中含有2个氢原子、1个硫原子和4个氧原子,即X的化学式是 H2SO4.故填:H2SO4;
(3)试剂②是用来调节溶液pH到2.7~3.7,目的让铁离子全部沉淀,除杂实验不能引入新的杂质;NaOH虽然可以将铁元素完全沉淀,但是会引入新的杂质离子--钠离子,ZnO、Zn(OH)2可以反应调节溶液pH到2.7~3.7,使铁离子沉淀,同时不引入新的杂质,ZnSO4不能调节溶液pH,且引入杂质硫酸根离子;故填:AB;
(4)结晶操作的过程包括:蒸发浓缩、冷却结晶;故填:冷却结晶;
(5)洗涤晶体表面的杂质离子,同时减少皓钒晶体的损失;在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是,晶体溶于水,不溶于酒精,所以目的是为了冲洗掉晶体表面的杂质离子,防止晶体溶解,影响产率;故填:防止晶体因溶解于水而损耗(酒精易挥发,更有利于晶体快速干燥);
[测定硫酸锌晶体ZnSO4xH2O中结晶水的含量]
(1)氢氧化钠溶液能吸收空气中的二氧化碳生成碳酸钠和水;实验中还要避免空气中的水蒸气以及从装置A中带出的水蒸气,所以要用浓硫酸进行干燥;故填:CO2+2NaOH=Na2CO3+H2O;A;
(2)实验过程中若不通入CO2,则最后称量玻璃管中固体偏重,所以所得中结晶水的质量偏小,使测定的结果偏小;
28.7g皓矾晶体中结晶水的质量为28.7g-16.1g=12.6g,ZnSO4xH2O中结晶水的质量分数为
![]()
解得x=7。
故填:偏小;7。