题目内容
某城市做出了冬季市区禁止使用原煤取暖的规定,暂不具备集体供暖条件的居民可使用“环保煤”取暖.原煤中含有FeS2,燃烧过程中产生的SO2(4FeS2+11O2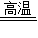 2Fe2O3+8SO2)将对空气造成严重污染.向原煤中加入适量石灰石就可以制成“环保煤”,通过2CaCO3+2SO2+O2
2Fe2O3+8SO2)将对空气造成严重污染.向原煤中加入适量石灰石就可以制成“环保煤”,通过2CaCO3+2SO2+O2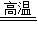 2CaSO4+2CO2反应,消除SO2对空气的污染.现有含FeS2质量分数为5.7%的原煤1000kg,理论上需加入纯度为95%的石灰石多少千克才能制成合格的“环保煤”?
2CaSO4+2CO2反应,消除SO2对空气的污染.现有含FeS2质量分数为5.7%的原煤1000kg,理论上需加入纯度为95%的石灰石多少千克才能制成合格的“环保煤”?
【答案】分析:解决本题时涉及两个反应,可根据每个反应分步逐一进行计算:先由FeS2质量计算出生成的SO2质量,再由SO2质量计算出石灰石的质量;也可以先根据两个反应的化学方程式找出FeS2与CaCO3的转化关系,综合成一步计算:根据反应4FeS2+11O2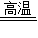 2Fe2O3+8SO2,可得4FeS2~8SO2,根据反应2CaCO3+2SO2+O2
2Fe2O3+8SO2,可得4FeS2~8SO2,根据反应2CaCO3+2SO2+O2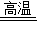 2CaSO4+2CO2,可得2SO2~2CaCO3,综合可得:FeS2~2CaCO3.
2CaSO4+2CO2,可得2SO2~2CaCO3,综合可得:FeS2~2CaCO3.
解答:解:设需加入纯度为95%的石灰石的质量为x
根据题意可知:FeS2~2CaCO3
120 200
1000kg×5.7% 95%x
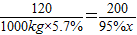
解之得x=100Kg
答:需加入纯度为95%的石灰石100千克.
点评:利用物质间的转化关系,可以简化计算过程,在关系建立时要注意到反应中的计量数.
 2Fe2O3+8SO2,可得4FeS2~8SO2,根据反应2CaCO3+2SO2+O2
2Fe2O3+8SO2,可得4FeS2~8SO2,根据反应2CaCO3+2SO2+O2 2CaSO4+2CO2,可得2SO2~2CaCO3,综合可得:FeS2~2CaCO3.
2CaSO4+2CO2,可得2SO2~2CaCO3,综合可得:FeS2~2CaCO3.解答:解:设需加入纯度为95%的石灰石的质量为x
根据题意可知:FeS2~2CaCO3
120 200
1000kg×5.7% 95%x
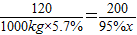
解之得x=100Kg
答:需加入纯度为95%的石灰石100千克.
点评:利用物质间的转化关系,可以简化计算过程,在关系建立时要注意到反应中的计量数.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 )将对空气造成严重污染。向原煤中加入适量石灰石就可以制成“环保煤”,通过
)将对空气造成严重污染。向原煤中加入适量石灰石就可以制成“环保煤”,通过 反应,消除SO2 对空气的污染。现有含FeS2 质量分数为5.7%的原煤1000kg ,理论上需加入纯度为95%的石灰石多少千克才能制成合格的“环保煤”?
反应,消除SO2 对空气的污染。现有含FeS2 质量分数为5.7%的原煤1000kg ,理论上需加入纯度为95%的石灰石多少千克才能制成合格的“环保煤”?