题目内容
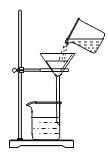
【题目】如图所示,是为了验证稀硫酸化学性质所做的三个实验,回答下列问题.
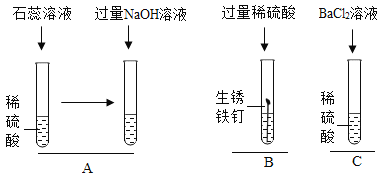
(1)A实验最终能观察到的现象是____;
(2)B实验能体现出稀硫酸具有的化学性质是____;
(3)C实验中发生反应的化学方程式为______;
(4)写出B中的一个化学反应方程式____.
【答案】溶液呈蓝色 能与金属氧化物和金属反应 H2SO4+BaCl2═BaSO4↓+2HCl Fe2O3+3H2SO4=Fe2(SO4)3+3H2O或Fe + H2SO4 = FeSO4 + H2↑
【解析】
(1)氢氧化钠过量,溶液呈碱性,石蕊显蓝色;
(2)铁锈的主要成分是氧化铁,是金属氧化物,与硫酸反应生成硫酸铁和水,被硫酸反应完后,里面的铁继续与硫酸反应生成硫酸亚铁和氢气。B实验能体现出稀硫酸具有的化学性质是能与金属氧化物和金属反应;
(3)氯化钡与硫酸反应生成硫酸钡沉淀和氯化氢,化学方程式为:H2SO4+BaCl2═BaSO4↓+2HCl;
(4)B中发生的反应分别为氧化铁与硫酸反应生成硫酸铁和水,铁与硫酸反应生成硫酸亚铁和氢气,反应的化学反应方程式分别为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,Fe + H2SO4 = FeSO4 + H2↑。

练习册系列答案
相关题目