题目内容
盖尔达法分解蛋白质的过程可表示为蛋白质 硫酸铵
硫酸铵 氨,为了测定某牛奶样品中蛋白质的含量,取30mL牛奶用盖尔达法分离蛋白质,把氮元素完全转化成氨(NH3),用50g4.9%稀H2SO4溶液吸收后,剩余的酸需要用38.0g4.0%的NaOH溶液中和,问
氨,为了测定某牛奶样品中蛋白质的含量,取30mL牛奶用盖尔达法分离蛋白质,把氮元素完全转化成氨(NH3),用50g4.9%稀H2SO4溶液吸收后,剩余的酸需要用38.0g4.0%的NaOH溶液中和,问
(1)已知硫酸吸收氨气时发生化合反应生成(NH4)2SO4,请写出上述过程中与硫酸有关的反应的化学方程式.
(2)30mL牛奶中共含有多少克氮?
(3)如果蛋白质中含氮16%(质量分数),则牛奶中含蛋白质的质量分数是多少?(牛奶的密度为1.03g/cm3)
 硫酸铵
硫酸铵 氨,为了测定某牛奶样品中蛋白质的含量,取30mL牛奶用盖尔达法分离蛋白质,把氮元素完全转化成氨(NH3),用50g4.9%稀H2SO4溶液吸收后,剩余的酸需要用38.0g4.0%的NaOH溶液中和,问
氨,为了测定某牛奶样品中蛋白质的含量,取30mL牛奶用盖尔达法分离蛋白质,把氮元素完全转化成氨(NH3),用50g4.9%稀H2SO4溶液吸收后,剩余的酸需要用38.0g4.0%的NaOH溶液中和,问(1)已知硫酸吸收氨气时发生化合反应生成(NH4)2SO4,请写出上述过程中与硫酸有关的反应的化学方程式.
(2)30mL牛奶中共含有多少克氮?
(3)如果蛋白质中含氮16%(质量分数),则牛奶中含蛋白质的质量分数是多少?(牛奶的密度为1.03g/cm3)
解:(1)2NH3+H2SO4=(NH4)2SO4;2NaOH+H2SO4=Na2SO4+2H2O
(2)设用38.0g4.0%的NaOH溶液中和的硫酸的质量为X
2NaOH+H2SO4=Na2SO4+2H2O
80 98
38.0g×4.0% 4.9%×X
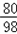 =
=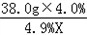
设与硫酸反应的氨气的质量为Y
2NH3+H2SO4=(NH4)2SO4
34 98
Y (50g﹣38g)×4.9%
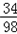 =
=
Y=0.204g
氨气中所含氮元素的质量为0.204g×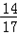 ×100%=0.168g
×100%=0.168g
答:30ml牛奶中共含有氮元素的质量为0.168g
(3)牛奶中含蛋白质的质量为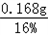 =1.05g
=1.05g
牛奶中蛋白质的质量分数为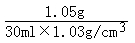 ×100%=3.4%
×100%=3.4%
答:牛奶中蛋白质的质量分数为3.4%
(2)设用38.0g4.0%的NaOH溶液中和的硫酸的质量为X
2NaOH+H2SO4=Na2SO4+2H2O
80 98
38.0g×4.0% 4.9%×X
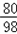 =
=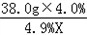
设与硫酸反应的氨气的质量为Y
2NH3+H2SO4=(NH4)2SO4
34 98
Y (50g﹣38g)×4.9%
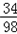 =
=
Y=0.204g
氨气中所含氮元素的质量为0.204g×
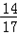 ×100%=0.168g
×100%=0.168g答:30ml牛奶中共含有氮元素的质量为0.168g
(3)牛奶中含蛋白质的质量为
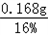 =1.05g
=1.05g牛奶中蛋白质的质量分数为
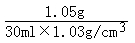 ×100%=3.4%
×100%=3.4%答:牛奶中蛋白质的质量分数为3.4%

练习册系列答案
相关题目
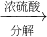 硫酸铵
硫酸铵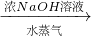 氨,为了测定某牛奶样品中蛋白质的含量,取30mL牛奶用盖尔达法分离蛋白质,把氮元素完全转化成氨(NH3),用50g4.9%稀H2SO4溶液吸收后,剩余的酸需要用38.0g4.0%的NaOH溶液中和,问
氨,为了测定某牛奶样品中蛋白质的含量,取30mL牛奶用盖尔达法分离蛋白质,把氮元素完全转化成氨(NH3),用50g4.9%稀H2SO4溶液吸收后,剩余的酸需要用38.0g4.0%的NaOH溶液中和,问 硫酸铵
硫酸铵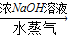 氨,为了测定某牛奶样品中蛋白质的含量,取30mL牛奶用盖尔达法分离蛋白质,把氮元素完全转化成氨(NH3),用50g4.9%稀H2SO4溶液吸收后,剩余的酸需要用38.0g4.0%的NaOH溶液中和,问
氨,为了测定某牛奶样品中蛋白质的含量,取30mL牛奶用盖尔达法分离蛋白质,把氮元素完全转化成氨(NH3),用50g4.9%稀H2SO4溶液吸收后,剩余的酸需要用38.0g4.0%的NaOH溶液中和,问 硫酸铵
硫酸铵 氨,为了测定某牛奶样品中蛋白质的含量,取30mL牛奶用盖尔达法分离蛋白质,把氮元素完全转化成氨(NH3),用50g4.9%稀H2SO4溶液吸收后,剩余的酸需要用38.0g4.0%的NaOH溶液中和,问
氨,为了测定某牛奶样品中蛋白质的含量,取30mL牛奶用盖尔达法分离蛋白质,把氮元素完全转化成氨(NH3),用50g4.9%稀H2SO4溶液吸收后,剩余的酸需要用38.0g4.0%的NaOH溶液中和,问