题目内容
【题目】某化学课外小组同学,用如图所示实验验证质量守恒定律.
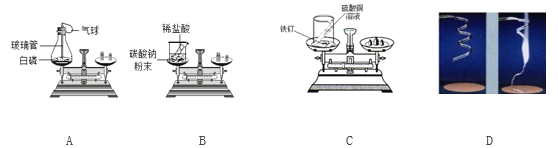
(1)甲同学用A装置实验,在瓶中先铺一层细沙,其作用是___;此实验中气球的作用是____。
(2)乙同学用B装置实验,反应的化学方程式是_____。发现天平的指针偏右.造成天平的指针向右偏转的原因是______.
(3)丙同学用C装置实验,发生反应的化学方程式_____;观察到的现象是________;最后天平的指针(填序号)______(a.偏左 b.偏右 c.不偏转 d.无法预测).
(4)丁同学用图D中的镁在空气中燃烧的实验来验证质量守恒定律时,发现一定质量的镁完全燃烧后留下的固体质量比反应前镁的质量轻,联系实验现象,可能的原因是________。
(5)综上所述,ABCD所示四个实验中能用质量守恒定律解释的是实验_______(选填字母序号,下同)上述现象能用来验证质量守恒定律的是实验_______。
【答案】防止白磷燃烧使锥形瓶炸裂 防止气体受热膨胀把橡胶塞弹开 Na2CO3+2HCl=2NaCl+H2O+CO2↑ 盐酸与碳酸钠粉反应生成二氧化碳气体逸出,使左盘内质量减小 Fe+CuSO4=Cu+ FeSO4 铁钉表面覆盖一层红色物质,溶液由蓝色逐渐变成浅绿色 C 部分生成物氧化镁以白烟的形式逸散到空气中了 ABCD AC
【解析】
(1)白磷燃烧产生的热量会使锥形瓶底部受热不匀发生炸裂,瓶底放细沙可以防止白磷燃烧使锥形瓶炸裂,故填防止白磷燃烧使锥形瓶炸裂;
白磷燃烧放出的热量会使瓶内气体受热膨胀把橡皮塞弹出,加一个小气球可起到缓冲作用,故填防止气体受热膨胀把橡胶塞弹开。
(2)B装置中碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,故反应的化学方程式写为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
反应的容器是开放的烧杯,盐酸与碳酸钠粉末反应生成二氧化碳气体逸出,使左盘内质量减小,造成天平的指针向右偏转,故填盐酸与碳酸钠粉末反应生成二氧化碳气体逸出,使左盘内质量减小。
(3)铁钉中的铁与硫酸铜反应生成硫酸亚铁和铜,故反应的化学方程式写为:Fe+CuSO4=Cu+ FeSO4;
观察到的现象为铁钉表面覆盖一层红色物质,溶液由蓝色逐渐变成浅绿色,故填铁钉表面覆盖一层红色物质,溶液由蓝色逐渐变成浅绿色;
铁钉与硫酸铜溶液反应时既没有气体参加反应,也没有气体生成,容器内物质的总质量不变,所以天平的指针不偏转,故填C。
(4)镁条燃烧后有白烟出现,生成的部分氧化镁随白烟逸散到空气中使固体质量减少,故填部分生成物氧化镁以白烟的形式逸散到空气中了。
(5)ABCD四个实验均发生了化学反应,均能用质量守恒定律来解释,故填ABCD;
实验B、D反应后均有气体生成,且反应在开放的容器中进行,生成的气体逸散到空气中使容器内的总质量减少;实验AC均没有气体参加反应或生成,反应发生的容器内物质的总质量保持不变,所以能用来验证质量守恒定律的是实验AC,故填AC。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案