题目内容
【题目】Ⅰ. 模型是联系宏观与微观的桥梁。
(1)下图是钠原子结构示意图。
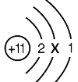
①x的数值为__________________。
②“11”指的是_______________。
③钠原子在化学反应中易失去1个电子,形成__________(填离子符号)。
(2)下图是氢分子和氧分子运动的示意图。

①在A、B和C中,能比较得出“温度越高,分子运动速率越快”的是________(填标号)。
②从图中可见,影响分子运动速率的因素除温度外,还与________________有关。
③举一个能说明“温度升高,分子运动速率加快”的生活事例:__________________________
Ⅱ.南京青奥会开幕式上应用环保烟花,减少了硫粉和金属粉末的使用,保护了环境。
(1)硫粉在空气中能燃烧,放出具有_____气味的气体,产生_____火焰,该反应的文字表达式为__________________,该反应属于化学基本反应类型中的_______________。
(2)铁粉在氧气中剧烈燃烧,放出大量的热,_____,生成黑色固体。在实验室进行此实验时,集气瓶底部放少量水或沙子的目的是_______________ 。
(3)A、B均是(1)、(2)反应中所涉及的物质,常温常压下,A为气体,B为固体,且A 和B含有一种相同元素。符合上述条件的A、B物质分别为___________、__________(写出两种可能的组合即可)。
【答案】 8 质子数 Na+ B C 分子质量大小 湿衣服在阳光下比在阴凉处干的快等(合理答案即可) 刺激性 淡蓝色 硫 + 氧气 → 二氧化硫 化合 火星四射 防止溅落的熔化物炸裂瓶底 氧气 、四氧化三铁;二氧化硫、硫;二氧化硫、四氧化三铁
【解析】Ⅰ.(1) ①根据质子数=电子数解答;
②根据粒子结构中圆圈中的数字表示质子数解答;
③在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略解答;
(2) ①根据对比运动速率的大小解答;
②根据氢分子和氧分子的质量分析;
③根据生活中与分子运动速率有关的事例解答;
Ⅱ. (1)根据硫燃烧的现象和文字表达式的书写方法分析回答;
(2)根据铁丝在氧气中燃烧的现象、注意事项等分析回答;
(3)根据题中信息结合物质的物理性质进行分析回答。
解:Ⅰ.(1) ①根据质子数=电子数可得:11=2+x+1,得x=8;
②粒子结构中圆圈中的数字表示质子数,故“11”指的是质子数;
③钠原子在化学反应中易失去1个电子,形成Na+;
(2) ①对比三幅图可知,B、C是同种分子且温度不同,平均运动速率不同,故在A、B和C中,能比较得出“温度越高,分子运动速率越快”的是B、C;
②对比三幅图可知,A、B温度一样,平均运动速率不同,分子质量大小不同(或种类不同),故影响分子运动速率的因素除温度外,还与分子质量大小有关;
③湿衣服在阳光下比在阴凉处干的快等;
Ⅱ.(1)硫粉在空气中燃烧发出淡蓝色的火焰,生成无色有刺激性气味的气体,反应的文字表达式为:硫+氧气![]() 二氧化硫,该反应符合“多变一”的形式,属于化学基本反应类型中的化合反应;
二氧化硫,该反应符合“多变一”的形式,属于化学基本反应类型中的化合反应;
(2)铁丝在氧气中剧烈燃烧、火星四射、生成一种黑色固体;在集气瓶底部放少量的水,其目的是防止溅落的熔化物炸裂瓶底;
(3)常温常压下,A为气体,B为固体,且A和B含有一种相同元素,结合上面的反应可知,A可以为氧气,B为四氧化三铁;A可以为二氧化硫,B为硫;A可以是二氧化硫,B为四氧化三铁等。

【题目】学习了MnO2对过氧化氢分解有催化作用的知识后,某同学想:CuO能否起到类似MnO2的催化作用呢?于是进行了以下探究.
【猜想】
Ⅰ.CuO不是催化剂,也不参与反应,反应前后质量和化学性质不变;
Ⅱ.CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ.CuO是反应的催化剂,反应前后 .
【实验】用天平称量0.2g CuO,取5mL 5%的过氧化氢溶液于试管中,进行如下实验:
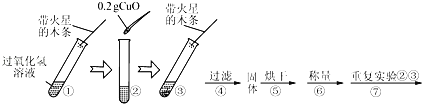
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
带火星的木条复燃 | 溶液中有气泡放出,带火星的木条复燃 | 猜想Ⅰ、Ⅱ不成立;猜想Ⅲ成立 |
(2)过氧化氢能被氧化铜催化分解放出氧气的文字表达式为 .