题目内容
【题目】计算:多少克高锰酸钾分解产生的氧气与电解1.8g水产生的氧气质量相等?
【答案】15.8g.
【解析】
试题分析:根据高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,水通电分解生成氢气和氧气,由参加反应的水的质量,计算出生成氧气的质量,由生成氧气的质量,由反应的化学方程式计算出需要高锰酸钾的质量即可.
解:由反应的化学方程式:2H2O![]() 2H2↑+O2↑,2KMnO4
2H2↑+O2↑,2KMnO4![]() K2MnO4+MnO2+O2↑可知,
K2MnO4+MnO2+O2↑可知,
则产生等质量的氧气,所消耗的水和高锰酸钾的关系为H2O~KMnO4,即所消耗的水和高锰酸钾的质量比为18:158,设需要高锰酸钾的质量为x
H2O~KMnO4,
18 158
1.8g x
![]() =
=![]()
x=15.8g
故答案为:15.8g.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】如表是元素周期表的一部分:
族 周期 | IA | 0 | ||||||
1 | 1 H 1.008 | ⅡA | ⅢA | ⅣA | V A | ⅥA | ⅦA | 2 He 4.003 |
2 | 3 Li 6.941 | 4 Be 9.012 | 5 B 10.8l | 6 C 12.01 | 7 N 14.0l | 8 O 16.00 | 9 F 19.00 | 10 Ne 20.18 |
3 | 11 Na 22.99 | 12 Mg 24.31 | 13 Al 26.98 | 14 Si 28.09 | 15 P 30.97 | 16 S 32.06 | 17 Cl 35.45 | 18 Ar 39.95 |
(1)原子序数是12的元素符号为 ;Be元素的相对原子质量为 ;
(2)相对原子质量为22.99的元素属 (填“金属”或“非金属”)元素;Ne的化学性质比较 (填“稳定”或“不稳定”).
(3)如图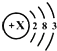 为某元素的原子结构示意图,该元素位于周期表中第 周期.
为某元素的原子结构示意图,该元素位于周期表中第 周期.
X= ,第一层内有 个电子,最外层有 个电子,该原子在化学反应中容易 (填“失去”或“得到”)电子,该原子的元素符号是 ,元素名称是 ,属于 (填“金属元素”或“非金属元素”).