题目内容
【题目】化学实验是科学探究的重要途径.请根据下列实验图示回答相关问题:

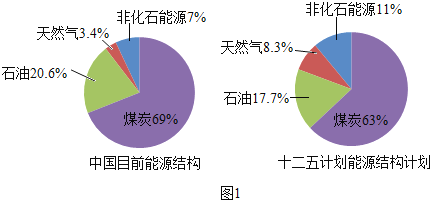
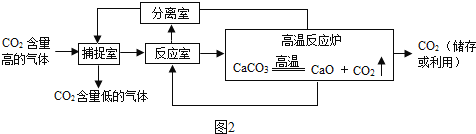
(1)A是实验室制备气体的发生与收集装置.用过氧化氢溶液与二氧化锰制取氧气的化学方程式为 ,制取氧气、二氧化碳可用同样的发生装置,原因是 ,选择收集装置的依据是 ;
(2)B实验中设计合理的是 (填“①”或“②”),另一装置设计中存在的问题是 ;
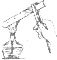
(3)C是定量实验,选择仪器不恰当或操作不规范都会导致实验结果有误差.实验时选择量筒规格应为 (填“50mL”或“100mL”,称量时砝码与药品位置放反了(1g以下使用游码),所得溶液的质量分数 15%(填“小于”、“等于”或“大于”).
【答案】(1)2H2O2![]() 2H2O+O2↑;都是液体和固体反应,不需要加热;气体的密度,溶解性等.
2H2O+O2↑;都是液体和固体反应,不需要加热;气体的密度,溶解性等.
(2)①;②装置不密封,生成的二氧化碳扩散到空气中,没有称量计入反应后的总质量.
(3)50mL;小于.
【解析】
试题分析:(1)通常情况下,过氧化氢在二氧化锰的催化作用下,分解生成水和氧气;
根据反应物状态、反应条件可以选择发生装置,根据气体的密度、水溶性可以选择收集装置;
(2)只有科学地设计实验、进行实验,才能够得出正确的结论;
(3)选择量筒时,量程应该大于或等于量取的液体体积,并且应该和量取的液体体积最接近;如果操作不当,会影响实验结果,甚至会导致实验失败.
解:(1)用过氧化氢溶液与二氧化锰制取氧气的化学方程式为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
制取氧气、二氧化碳可用同样的发生装置,原因是都是液体和固体反应,不需要加热,选择收集装置的依据是气体的密度,溶解性等.
故填:2H2O2![]() 2H2O+O2↑;都是液体和固体反应,不需要加热;气体的密度,溶解性等.
2H2O+O2↑;都是液体和固体反应,不需要加热;气体的密度,溶解性等.
(2)B实验中设计合理的是①,能够验证质量守恒定律;设计不合理的是②,因为装置不密封,生成的二氧化碳扩散到空气中,没有称量计入反应后的总质量,无法验证质量守恒定律.
故填:①;②装置不密封,生成的二氧化碳扩散到空气中,没有称量计入反应后的总质量.
(3)50g溶液中氯化钠的质量为:50g×15%=7.5g,
水的质量为:50g﹣7.5g=42.5g,需要量取的水的体积为:42.5g/(1g/mL)=42.5mL,实验时选择量筒规格应为50mL;
称量时砝码与药品位置放反了,则称量的氯化钠质量为:7g﹣0.5g=6.5g,
所得溶液的质量分数为:![]() ×100%=13.3%<15%,
×100%=13.3%<15%,
故填:50mL;小于.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某自然科学兴趣小组,设计了如图所示的装置,用来研究不同金属跟稀硫酸反应的快慢.他们用此装置,选择了甲、乙、丙、丁四种大小相同的金属片,分别与相同体积、相同质量分数的稀硫酸反应,观察30s内从导管口冒出的氢气泡多少,记录在下表中.(“+”越多表示产生的气泡越多).
金属 | 甲 | 乙 | 丙 | 丁 |
氢气泡多少 | ++ | ++++ | +++ | + |
如果四种金属分别是镁、铝、铁、锌中的一种,则丁最有可能是( )
A.镁 B.铝 C.铁 D.锌