��Ŀ����
����Ŀ��ѧϰ�˶������̶Թ�������ֽ��д����õ�֪ʶ��С��ͬѧ�룺
������ͭ�ܷ������ƶ������̵Ĵ������أ����ǽ���������̽����

�����룩
a������ͭ���Ǵ�����Ҳ�����뷴Ӧ����Ӧǰ�������ͻ�ѧ���ʲ��䣮
b������ͭ���뷴Ӧ����Ӧǰ�������ͻ�ѧ���ʷ����˸ı䣮
c������ͭ�Ƿ�Ӧ�Ĵ�������Ӧǰ��_________________________��
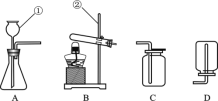
��ʵ�飩����ƽ����0.2g����ͭ��ȡ5mL5%�Ĺ���������Һ���Թ��У�ʵ��������£�
��1��������������Թ�����____________�ų���������ľ����ȼ������Ľ����________________��
��2������ߵ���������Һ���д������ݲ�����������ľ��______���ɴ˿ɵó����ۣ�����c������
��3������ٵ�Ŀ����_____________________________
��������С��ͬѧ̽��Ӱ�췴Ӧ���ʲ������ص����ʵ�����ݡ�
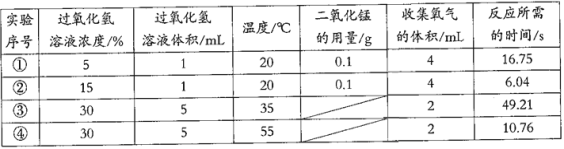
�ף�ͨ��ʵ���������Աȿ�֪����ѧ��Ӧ������_________________�йأ���ʵ��ۺܶ͢Աȿ�֪����ѧ��Ӧ�������¶ȵĹ�ϵ��___________________��
�ҡ���һ����15%�Ĺ���������Һ��������Ϊ�˼�С��Ӧ���ʣ��ɼ�������ˮϡ�ͣ�����������������_________________��ѡ���С�����䡱������
���𰸡������ͻ�ѧ���ʶ����䡡 �� ���� 0.2�� �� ��ȼ�� �� �Աȡ� �� ��Ӧ��Ũ���йأ� �ۺܶ͢Աȣ����¶ȵĹ�ϵ���¶�Խ�ߣ���Ӧ����Խ�� �� ����
��������
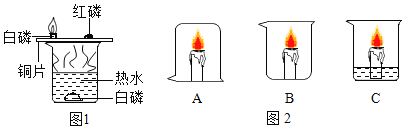
�����ڷ�Ӧǰ�������ͻ�ѧ���ʶ�������
��1������3�д����ǵ�ľ����ȼ�ˣ�˵���н϶���������ɣ�������Ϊ������ð����
����ͭ�ڸ÷�Ӧ���������������ڷ�Ӧǰ��������ͻ�ѧ���ʲ��䣬�ʲ���Ľ��������ͭ��������Ϊ0.2g
��2������ͭ�Ǹ÷�Ӧ�Ĵ���������ߵ������Ǵ����ǵ�ľ����ȼ��
��3������1��Ϊ��������ʵ��Աȣ�
��4��ʵ��ٺ͢��У����ݿ��Ʊ�������ֻ�й��������Ũ�Ȳ�ͬ������Ӧ�Ŀ�����ͬ����˵����ѧ��Ӧ����������������Ũ���йأ�ʵ��ۺܵ͢��¶Ȳ�ͬ���¶�Խ�ߣ���Ӧ�����ʱ��Խ�̣��ʢۺܶ͢Ա�˵�������¶ȵĹ�ϵ���¶�Խ�ߣ���Ӧ����Խ�졣�ı���������Ũ�ȣ�ֻ�ܸı䷴Ӧ�����ʣ����Dz��ܸı��������������

����Ŀ����ѧС���ͬѧ����þ���ڿ�����ȼ��ʵ��ʱ���������ɵİ�ɫ�����л������������ĵ���ɫ�Ĺ��塣��������⣩Ϊʲô�����ɵ���ɫ���壿���������ϣ���¼�����м������ʵ���ɫ��
���� | MgO������þ�� | MgCl2 | Mg3N2 ������þ�� | Mg��NO3��2 | MgCO3 | Mg��OH��2 |
��ɫ | ��ɫ | ��ɫ | ����ɫ | ��ɫ | ��ɫ | ��ɫ |
С��ͬѧ��Ϊ���ز����Ȼ�þ����ɫ�������ǣ�___________________��
��������룩��������С����Ϊ����ɫ��������ǺͿ����е�_____________��Ӧ���ɵġ�
��ʵ��̽����С�����ʵ������֤�Լ��IJ��룬���ķ��������ǣ�__________��
��ʵ����ۣ�����С���ʵ������д��þ���ڿ�����ȼ�յ��������ű���ʽ��_____________�� ��____________________________��
����˼�����ۣ�ͨ������ʵ�飬���ȼ����ʲô����ʶ________________