题目内容
【题目】A~F为初中化学常见物质,它们由H、C、O、Cl、Na、Ca中的某些元素组成。
(1)A为氧化物,可用于制备改良酸性土壤的碱,写出用A制备这种碱的化学方程式____。
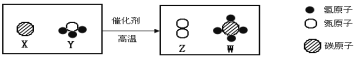
(2)B、C均为液体,且组成元素相同,C在一定条件下可生成B,B的化学式为____。
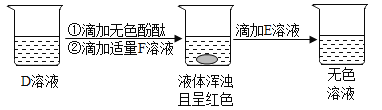
(3)D用于玻璃、造纸、纺织、洗涤剂的生产,取D溶液进行实验,操作及部分现象如下图所示。D与F反应的化学方程式为________________。最后所得无色溶液中可能含有的溶质是__(写化学式)。
【答案】CaO+H2O=Ca(OH)2 H2O Ca(OH)2+Na2CO3=CaCO3↓+2NaOH CaCl2、NaCl或CaCl2、NaCl、HCl(合理即可)
【解析】
(1)A为氧化物,可用于制备改良酸性土壤的碱,那么A是氧化钙,氧化钙和水反应生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2;
(2)B、C均为液体,且组成元素相同,C在一定条件下可生成B,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,因此B是水,C是过氧化氢;B的化学式为:H2O;
(3)D用于玻璃、造纸、纺织、洗涤剂的生产,因此D是碳酸钠;取D溶液进行实验,操作及部分现象如下图所示,碳酸钠和氢氧化钙反应生成碳酸钙白色沉淀和氢氧化钠,因此F是氢氧化钙,D与F反应的化学方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,氢氧化钠和盐酸反应生成氯化钠和水,因此最后所得无色溶液中可能含有的溶质是氯化钙、氯化钠或氯化钙、氯化钠、氯化氢等。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】NH4C1和Na2SO4的溶解度表及溶解度曲线如下。下列说法错误的是
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度 S/g | NH4C1 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
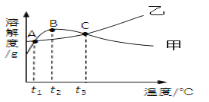
A. t2应介于30℃ ~50℃
B. 10℃ 时,饱和的Na2SO4溶液的溶质质量分数为9.6%
C. 甲、乙饱和溶液从t3降温到t2,溶质的质量分数都变小
D. B点、C点对应的甲的溶液,溶质质量分数大小关系为B>C
【题目】善于在物质间寻找规律,是学好化学的方法之一。下列表格中的三组物质,小星同学对它们作了归纳,请你帮他完成相应内容。(说明:①X为待定物质;②规律不能重复)
物质 | 变化规律 | X的化学式 | 排列规律 |
(1)Na、Al、Cu、Fe、X | 金属活动性:由强到弱 | _________ | Na、X、Al、Fe、Cu. |
(2)FeS、FeO、Fe3O4、X | 物质中铁元素的质量分数:由多到少 | Fe2O3 | ________________ |
(3)NH3、NO、NO2、N2、X | _______________ | N2O3 | NO2、N2O3、NO、N2、NH3 |