��Ŀ����
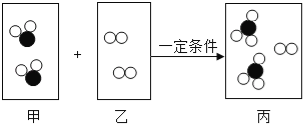
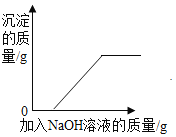
����Ŀ��ij�������мס����������䣬�����ŷŵķ�ˮ�о����������ӣ���������Щ������Ba2+��Cu2+��K+��NO3����SO42����CO32�����׳����ˮ�ʼ��ԣ������ס��ҳ���ķ�ˮ���ʵ�������ϣ�ʹ��ˮ�е�ijЩ����ǡ����ȫ��Ӧת��Ϊ��������ͼ��ʾ�������з�����ȷ���ǣ�������
A.�׳���ķ�ˮ���е�������K+��CO32����NO3��
B.ͼ�еij��������ᱵ��̼�ᱵ
C.ͼ����Һ�����������������ӵ���Ŀ��Ϊ1��1
D.�����ҳ���ķ�ˮ�м����������ۣ���ַ�Ӧ����ˣ���Һ��ֱ���ŷ�
���𰸡�C
��������
�������⣬![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ���������У����������������̼������γ����ᱵ��̼�ᱵ�������ܹ��棬ͭ���Ӻ�̼������Ӳ��ܹ��棬�����������������γɵ�����Һ����ʼ��ԣ�̼����γɵ�����Һ�ʼ��ԣ��׳����ˮ�ʼ��ԣ���׳����ˮ�е�����Ϊ̼����������ӡ���������ҳ����ˮ�е�����Ϊ�����ӡ�ͭ���ӡ��������
���������У����������������̼������γ����ᱵ��̼�ᱵ�������ܹ��棬ͭ���Ӻ�̼������Ӳ��ܹ��棬�����������������γɵ�����Һ����ʼ��ԣ�̼����γɵ�����Һ�ʼ��ԣ��׳����ˮ�ʼ��ԣ���׳����ˮ�е�����Ϊ̼����������ӡ���������ҳ����ˮ�е�����Ϊ�����ӡ�ͭ���ӡ��������
A���ɷ�����֪���׳����ˮ�е�����Ϊ̼����������ӡ��������Aѡ���������ȷ�����������⣻
B����������֮���γɳ����Ŀ����Կ�֪ͼ�еij��������ᱵ��̼�ᱵ��̼��ͭ��Bѡ���������ȷ�����������⣻
C���ס��ҷ�ˮ��Ϻ����ɵĿ�����������KNO3�������������������ӵ���Ŀ��Ϊ1��1��Cѡ�������ȷ���������⣻
D���ҳ����ˮ�е�����Ϊ�����ӡ�ͭ���ӡ�������������ҳ���ķ�ˮ�м����������ۣ�����ͭ���ӷ����û���Ӧ�����������Ӻ͵���ͭ����ַ�Ӧ����ˣ���Һ�������������Ӻͱ����ӣ�����ֱ���ŷţ�Dѡ���������ȷ�����������⡣��ѡC��

 ����ͬ�����Ծ�ϵ�д�
����ͬ�����Ծ�ϵ�д�����Ŀ���Ķ�������ϣ��ش����⡣
��Ԫ�ع㷺��������Ȼ���У��ڻ�ɽ�ڸ��������ʴ��ڣ��������ĺ�������Ҫ�Կ�������ʽ���ڣ���ʯ�ࣨCaSO42H2O����â����Na2SO410H2O���ȡ�������һ�ֵ���ɫ�Ĺ��壬������ˮ�������ڶ���̼��CS2������ɽ�緢ʱ��������Ԫ��ת�����������壻������Ԫ��ת���ɶ�������������������壬���������ڴ������ױ����������������������������������ˮ���ֱ���������������ᡣ
��1��������������Ԫ�ػ��ϼ۽Ƕȣ������仯������з��࣬���ݱ���������ɹ��ɣ�����ȱ�
������� | ���� | �⻯�� | ������ | �� | �� |
��ѧʽ | S | H2S | SO2 | H2SO3 | _____ |
SO3 | H2SO4 | Na2SO4 |
��2����ϲ��������ʵ����ʷ��������ϴȥճ���Թܱ��ϵ���Ӧѡ�õ��Լ���____��
��3����������Ԫ�صĻ��ϼ�Ϊ________�������ˮ��Һ��Ϊ�����ᣬ������¶���ڿ����������������û���Ӧ����������ɫ������д����ѧ����ʽ_________�������᳨�ڷ����ڿ����У���Һ��pH__����������������С����������������
��4�����������ĽǶ�Ԥ�⣬���������������������������ܷ�����ѧ��Ӧ����_______������ţ���
a O2 b NaOH c H2O d HCl
��5��H2SO3���ȶ����ֽ�������壨��H2CO3���ƣ���д��ϡ�������������ƣ�Na2SO3����Һ�������ֽⷴӦ�Ļ�ѧ����ʽ________��
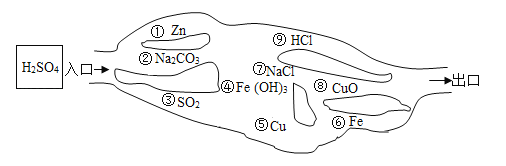
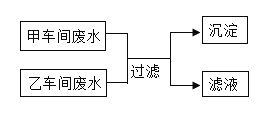
����Ŀ����ҵ�ϳ����õ�ʯ����Ȳ����![]() ʱ�����Ļҽ��Ͳ����Ʊ�����ԭ��
ʱ�����Ļҽ��Ͳ����Ʊ�����ԭ��![]() �ͳ�ϸ
�ͳ�ϸ![]() ��
��
![]() ��ʯ����Ȳ����
��ʯ����Ȳ����![]() ʱ�����ҽ��Ͳ����Ĺ������£���ʯ
ʱ�����ҽ��Ͳ����Ĺ������£���ʯ![]() �ҽ�
�ҽ�![]() ���������е�ʯ��ˮ��Ӧ�����������ƺ���Ȳ��д���÷�Ӧ�Ļ�ѧ����ʽ ______����������Ҫ�ɷ���
���������е�ʯ��ˮ��Ӧ�����������ƺ���Ȳ��д���÷�Ӧ�Ļ�ѧ����ʽ ______����������Ҫ�ɷ���![]() �� ______ ��
�� ______ ��
��![]() �Ʊ�
�Ʊ�![]() ��������ͼ��
��������ͼ��
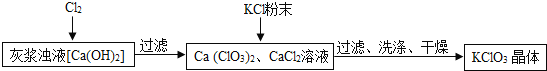
![]() ��ҽ���Һ��ͨ��
��ҽ���Һ��ͨ��![]() ���õ�
���õ�![]() ��
��![]() ��Һ����Ӧ��
��Һ����Ӧ��![]() ��
��![]() �Ļ�ѧ�������ֱ�Ϊ1��
�Ļ�ѧ�������ֱ�Ϊ1��![]() д���˷�Ӧ�Ļ�ѧ����ʽ ______ ��
д���˷�Ӧ�Ļ�ѧ����ʽ ______ ��
![]() �й������ڳ����µ��ܽ�����£�
�й������ڳ����µ��ܽ�����£�
���� |
|
|
| KCl |
�ܽ�� |
|
|
|
|
���������м���KCl��ĩ��KCl�� ______ ![]() �ѧʽ
�ѧʽ![]() �����˸��ֽⷴӦ���õ�
�����˸��ֽⷴӦ���õ�![]() ���壮����Ϊ�ܵõ�
���壮����Ϊ�ܵõ�![]() �����ԭ���� ______ ��
�����ԭ���� ______ ��
![]() ϴ��ʱ����ѡ������ϴ�Ӽ� ______
ϴ��ʱ����ѡ������ϴ�Ӽ� ______ ![]() ����ĸ���
����ĸ���![]() ��
��
A KCl������Һ![]() ��ˮ
��ˮ![]() ����
����![]() ��Һ
��Һ
��![]() �Ʊ���ϸ
�Ʊ���ϸ![]() ����������
����������![]() ע������
ע������![]() ��Һ��Ŀ�����ܽ�����е�������
��Һ��Ŀ�����ܽ�����е�������![]() ��
��
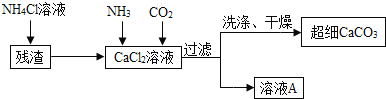
![]() ��
��![]() ��Һ��ͨ���������壬���ɳ�ϸ
��Һ��ͨ���������壬���ɳ�ϸ![]() �Ļ�ѧ����ʽ ______
�Ļ�ѧ����ʽ ______ ![]() ����
����![]() �Ƿ�ϴ�Ӹɾ��ķ����� ______ ��
�Ƿ�ϴ�Ӹɾ��ķ����� ______ ��
![]() ��������ҺA��ѭ��ʹ�ã�����Ҫ�ɷֵĻ�ѧʽ�� ______ ��
��������ҺA��ѭ��ʹ�ã�����Ҫ�ɷֵĻ�ѧʽ�� ______ ��