题目内容
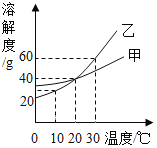
【题目】小丞博同学在实验室配制50g溶质质量分数为15%的氯化钠溶液,实验操作如图:
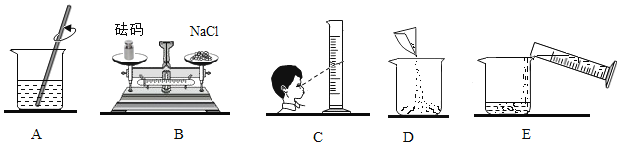
(1)其中操作错误的步骤是______( 填字母) ;
(2)该实验的正确操作顺序为______( 填字母序号) ;
(3)A中玻璃棒的作用是______;
(4)改正操作后,小丞博同学顺利完成了溶液的配制。经检测,所配制溶液的溶质质量分数偏小,其原因可能是______( 填序号) 。
①氯化钠固体不纯
②称量时,砝码端忘记垫上质量相同的纸片
③量取水时,仰视读数
④装瓶时,有少量溶液洒出
⑤量取水时,俯视读数
⑥砝码生锈了
(5)取上述溶液10g,加水______g,可得到5%的NaCl溶液。
【答案】BC BDCEA 搅拌,加速溶解 ①②③ 20
【解析】
(1)称量物品应遵循“左物右码”,图示放反了;量筒读数时,视线与液体凹液面的最低处保持水平,所以操作错误的步骤是BC;
(2)配制一定质量分数溶液的步骤是:计算、称量、溶解、装瓶,所以该实验的正确操作顺序为BDCEA;
(3)在溶解过程中,玻璃棒的作用是:搅拌,加速溶解;
(4)①称量含杂质的氯化钠来配制溶液,会导致氯化钠减少,所配制溶液的溶质质量分数偏小,故①正确;②称量时,砝码端忘垫质量相同的纸片,会导致氯化钠的质量减少,所配制溶液的溶质质量分数偏小,故②正确;③用量筒量取水时仰视读数,会导致溶剂质量增多,所配制溶液的溶质质量分数偏小,故③正确;④将配制好的溶液往试剂瓶中转移时有少量溅出,溶质质量分数不变,故④错误。故选①②③。
(5)取上述溶液10g,加水=![]() -10g=20g,可得到5%的NaCl溶液。
-10g=20g,可得到5%的NaCl溶液。

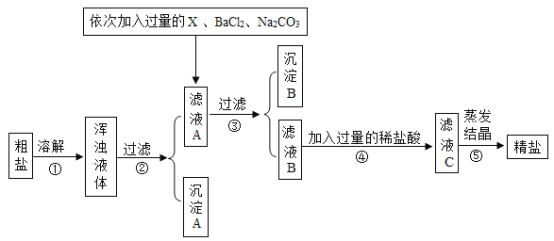
【题目】海水晒盐可制得粗盐,粗盐除氯化钠外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,以下是某化学兴趣小组制定的一套制备精盐的实验方案,步骤如图所示:
(查阅资料)可溶性钡盐有剧毒,可以导致蛋白质变性,破坏体内一系列生理活动。
(1)步骤①中溶解粗盐时所加水的质量不宜过多,也不宜过少,过少会造成精盐的产率_____(填“偏高”或“偏低”)。沉淀B中共有_____种物质。
(2)符合试剂X要求的是_____(选填字母)。
A 碳酸钙
B 氢氧化钡溶液
C 氢氧化钠溶液
D 氢氧化钙溶液 E 氢氧化钾溶液
(3)甲乙同学为了证明滤液C是否有盐酸剩余,设计了下列实验方法进行实验探究。
(实验探究)
实验 | 实验操作 | 实验现象 | 实验结论 |
甲 | 取样,加入足量AgNO3溶液。 | _____ | 盐酸有剩余。写出盐酸发生反应的化学方程式_____。 |
乙 | 取样,加入适量的_____溶液。 | 有气泡逸出 | 盐酸有剩余。 |
丙同学认为甲的实验方案不严密,请说出理由_____。