题目内容
【题目】某化学兴趣小组对水蒸气通过灼热的焦炭后,得到的混合气体主要成分产生了兴趣.同学们决定通过实验进行探究.
(提出猜想)该混合气体成分为:一氧化碳、二氧化碳、氢气和水蒸气.
(查阅资料)
a 无水硫酸铜遇水由白色变为蓝色;
b 碱石灰是固体氢氧化钠和氧化钙的混合物;
c H2+CuO![]() Cu+H2O;
Cu+H2O;
d CO+CuO![]() Cu+CO2.
Cu+CO2.
(实验过程)
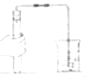
同学们在老师的指导下设计了如图所示装置,并进行了实验(部分夹持仪器已略去).
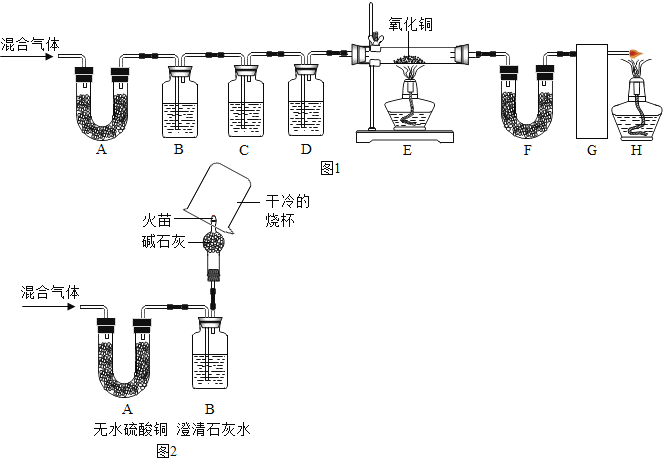
(1)装置A中无水硫酸铜变蓝,装置B中澄清石灰水变浑浊,由此得出的结论______.
(2)装置D中的药品为______.
(3)同学们通过观察装置E、F中的现象后,证明了混合气中含有氢气.为了证明第四种气体的存在,可用装有______(填试剂名称)的装置G.
(实验结论)猜想正确.
(实验反思)
经过讨论,同学们将如图中装置C~H进行了简化,改进后的装置如图所示:
其中,干燥管中碱石灰的作用为______,烧杯上能观察到的现象是______,进一步证明第四种气体的存在实验操作是______.
【答案】混合气体中含有水蒸气和二氧化碳 浓硫酸 澄清石灰水 除去混合气体中剩余的CO2和水蒸气 烧杯内壁有水雾产生 将烧杯倒过来,倒入少量澄清石灰水,振荡
【解析】
(1)根据无水硫酸铜遇水变蓝,澄清石灰水遇二氧化碳变浑浊的特点可知,混合气体中有水蒸气和二氧化碳;
(2)为防止二氧化碳对一氧化碳的检验产生干扰,气体在通入E之前 应将气体中的二氧化碳吸收,氢氧化钠能与二氧化碳反应生成碳酸钠和水,C装置中应是浓氢氧化钠;为防止 水对氢气的检验产生干扰,气体在通入E之前 应将气体中的水吸收,浓硫酸具有吸水性,D装置中应是浓硫酸,目的是吸收混合气体中的水蒸气;
(3)根据猜想可知,第四种气体应为一氧化碳,一氧化碳能与氧化铜反应生成二氧化碳和铜,若要一氧化碳的存在,只需证明反应后产物中存在二氧化碳即可,G中应盛放澄清石灰水;
[实验反思]
碱石灰是固体氢氧化钠和氧化钙的混合物,其中的氢氧化钠固体可吸收二氧化碳,氧化钙可吸收水蒸气;在尖嘴处点燃气体,在火焰上方罩一个干燥、洁净的烧杯,若烧杯壁上有小水珠(或水雾),则证明有氢气,因氢气燃烧生成水;将烧杯倒过来,倒入少量澄清石灰水,振荡,石灰水变浑浊,说明有一氧化碳,因一氧化碳燃烧生成了二氧化碳。

 高中必刷题系列答案
高中必刷题系列答案