题目内容
【题目】粗盐除去泥砂后含有氯化镁、硫酸钠、氯化钙等杂质,某同学对粗盐进一步提纯的实验操作过程如图所示:
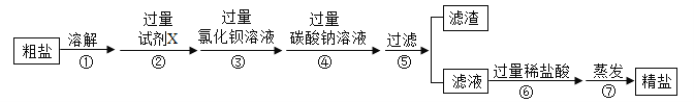
(1)实验中称取5.0g粗盐,为了使粗盐充分溶解(该温度下氯化钠的溶解度为36g/100g水)量取水所用量筒的规格为__________。
A 10mL
B 20mL
C 50mL
D 100mL
(2)步骤②所加试剂X的化学式为_______。
(3)步骤③的反应的化学方程式为_________。
(4)步骤④中加入过量碳酸钠的目的是______。
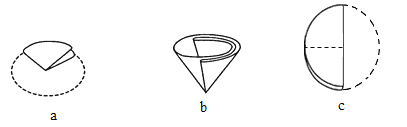
(5)步骤⑤过滤实验,制作过滤器的正确顺序为__。过滤后所得滤渣的化学式为___。
(6)步骤⑦蒸发实验除去____(填化学式)得到精盐。
【答案】B NaOH ![]() 除去溶液中的氯化钙和过量的氯化钡 cab Mg(OH)2 BaSO4 BaCO3 CaCO3 HCl、H2O
除去溶液中的氯化钙和过量的氯化钡 cab Mg(OH)2 BaSO4 BaCO3 CaCO3 HCl、H2O
【解析】
(1)该温度下氯化钠的溶解度为36g/100g水,溶解5g粗盐需要水的质量为x,![]() x=13.9mL,故选20mL的量筒,故选B;
x=13.9mL,故选20mL的量筒,故选B;
(2)经分析步骤②是除去镁离子,故应加入NaOH溶液,氢氧化钠能与氯化镁反应生成氢氧化镁沉淀和氯化钠;
(3)步骤③中加入过量氯化钡,氯化钡能与硫酸钠反应生成硫酸钡沉淀和氯化钠,该反应的化学方程式为:![]() ;
;
(4)步骤④中加入过量碳酸钠,碳酸钠能与氯化钙反应生成碳酸钙和氯化钠,也能与过量的氯化钡反应生成碳酸钡和氯化钠,故目的是:除去溶液中的氯化钙和过量的氯化钡;
(5)步骤⑤过滤实验,制作过滤器的正确顺序为c、a、b;
氢氧化钠与氯化镁反应生成氢氧化镁沉淀,氯化钡与硫酸钠反应生成硫酸钡沉淀,碳酸钠与氯化钙反应生成碳酸钙,碳酸钠与氯化钡反应生成碳酸钡沉淀,故过滤后所得滤渣的化学式为Mg(OH)2、BaSO4、CaCO3、BaCO3;
(6)步骤⑦蒸发实验,蒸发是通过加热蒸发水分,得到固体,由于盐酸具有挥发性,过量的HCl,可通过蒸发除去,故除去过量的HCl和H2O得到精盐。

【题目】2020年初,新型冠状病毒疫情爆发。一定浓度的乙醇、过氧化氢、过氧乙酸(CH3COOOH)、次氯酸钠(NaClO)等溶液能有效杀灭病毒。
(1)乙醇、过氧化氢、过氧乙酸、次氯酸钠中,属于有机化合物的是乙醇和__________。
(2)用作消毒剂的医用酒精中乙醇的体积分数为75%,就是指每100体积的医用酒精中含__的乙醇。大面积喷洒医用酒精易引发火灾,请写出乙醇完全燃烧的化学方程式:______。
(3)实验室常采用分解过氧化氢的方法制取氧气,化学方程式为_______。
质量分数为30%、5%的过氧化氢溶液以及水的密度见下表:
液体 | 质量分数为30%的过氧化氢溶液 | 质量分数为5%的过氧化氢溶液 | 水 |
密度 | 1.1g/cm3 | 1.0g/cm3 | 1.0g/cm3 |
要把50mL质量分数为30%的过氧化氢溶液稀释为质量分数为5%的过氧化氢溶液,需要水的体积为__________mL。
(4)利用次氯酸钠发生器,通过电解食盐水能够制得次氯酸钠溶液,该反应的化学方程式为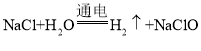 。请分析该反应中各元素化合价的变化:_______。
。请分析该反应中各元素化合价的变化:_______。