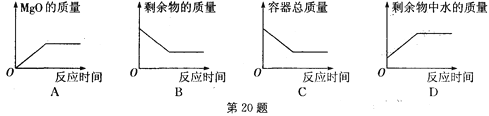
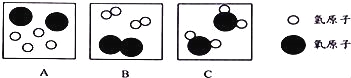
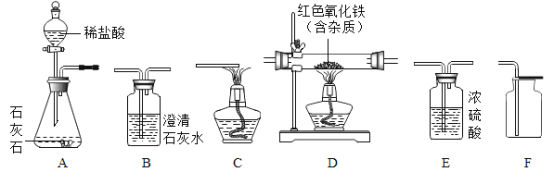
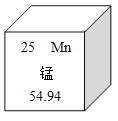
题目内容
【题目】如图是配制180g溶质质量分数为10%的NaCl溶液的实验操作示意图。

(1)正确的操作顺序是_____(填图中的数字序号)。
(2)请在图中画出即将向天平左侧托盘上加氯化钠固体进行称量时游码(用“![]() ”表示)的位置。
”表示)的位置。
![]()
(3)在称取氯化钠的过程中,观察到指针轻微的偏向分度盘的右侧,则接下来的操作应该是_____。
(4)实验中需要量取水的体积为_____mL,应选择规格为_____mL(选填“50”、“100”、“200”或“250”)的量筒来量取水。
(5)溶解时,用玻璃棒搅拌的作用是_____。
(6)下列操作会导致所配溶液的溶质质量分数偏大的是_____。
A.氯化钠固体不纯
B.配制溶液的烧杯事先用少量蒸馏水润洗
C.用量筒量取水时俯视读数
D.把配制好的溶液装入细口瓶时有少量液体洒出
【答案】②⑤①④③ ![]() 继续向左偏上添加氯化钠直至指针指向分度盘中间 162 200 加快氯化钠的溶解速率 C
继续向左偏上添加氯化钠直至指针指向分度盘中间 162 200 加快氯化钠的溶解速率 C
【解析】
(1)根据用固体溶质氯化钠配制溶液的步骤:计算-称量-溶解,先取氯化钠进行称取,倒入烧杯;然后量取水,倒入盛氯化钠的烧杯中;最后进行溶解;
(2)配制180g溶质质量分数为10%的NaCl溶液需要氯化钠的质量为:180g×10%=18g,砝码的质量为10g+5g=15g,游码的质量为3.0g,如图:![]() ;
;
(3)在称取氯化钠的过程中,观察到指针轻微的偏向分度盘的右侧,说明氯化钠的质量偏小,则接下来的操作应该是继续向左偏上添加氯化钠直至指针指向分度盘中间;
(4)需要量取的水的质量为:180g-18g=162g,体积为:162g÷1g/mL=162mL,需要选择规格为200mL的量筒来量取水;
(5)溶解时,用玻璃棒搅拌的作用是加快氯化钠的溶解速率;
(6)A、氯化钠固体不纯导致所配制溶液的溶质质量分数偏小,故错误;
B、配制溶液的烧杯事先用少量蒸馏水润洗造成水偏多,导致所配制溶液的溶质质量分数偏小,故错误;
C、用量筒量取水时俯视读数导致量取的水偏少,导致所配溶液的溶质质量分数偏大,故正确;
D、把配制好的溶液装入细口瓶时有少量液体洒出溶质质量分数是不变的,因为溶液是均一的,故错误。

 考前必练系列答案
考前必练系列答案【题目】为了探究金属活动性,同学们将锌和铜分别放入稀硫酸中,锌的表面有气泡产生而铜不反应,写出锌和稀硫酸反应的化学方程式:_____。
老师告诉同学,铜和浓硫酸在加热的条件下也能反应且产生气体。
(提出问题)铜与浓硫酸反应的生成物是什么?其中气体是什么?
(猜想假设)同学们对产生的气体作出了猜想。
猜想一:氢气;
猜想二:二氧化硫;
猜想三:氢气和二氧化硫的混合气体。
同学们作出以上猜想的依据是_____。
(査阅资料)(1)二氧化硫有刺激性气味,会污染空气;
(2)二氧化硫可以使品红溶液褪色,能被氢氧化钾溶液吸收;
(3)浓硫酸具有吸水性,可以干燥气体。
(实验探究)师生设计了如下装置进行实验(部分仪器省略),请完成下列表格。
主要实验步骤 | 主要现象 | 解释或结论 |
①加热装置A一段时间 | 装置B中的现象是_____ | 有二氧化硫生成 |
②点燃装置D处酒精灯 | 装置D玻璃管中无明显现象 | 猜想_____正确 |
③停止加热,将铜丝上提,向装置A中玻璃管鼓入空气 | ||
④冷却,观察A中溶液颜色 | A中液体变为_____色 | 有硫酸铜生成 |
(表达交流)
(1)在步骤③中,鼓入空气的目的是_____。
(2)铜与浓硫酸反应的化学方程式为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+_____。
CuSO4+SO2↑+_____。
(反思拓展)
若将装置A中铜丝换成锌片,随着反应的进行,硫酸的浓度逐渐变小,装置D玻璃管中看到的现象是_____。