题目内容
某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用下图所示装置,对获得的铜粉(含炭)样品进行实验,测定铜的质量分数。图中铁架台等装置已略去。请回答下列问题:

仪器:铁架台(含铁圈、铁夹)、分液漏斗、平底烧瓶、硬质玻璃管、干燥管、酒精灯、石棉网、洗气瓶等。
药品:红褐色(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰(固体氢氧化钠和氧化钙的混合物,可用来吸收水和CO2)。
(1)除上述仪器外,实验中还必须用到的仪器是 ;
(2)实验操作前,首先进行 检查。在C中加入样品粉末W g,D中装入药品后并称量为m1 g,连接好仪器。打开A的上塞、活塞,慢慢滴加溶液。对C进行加热。当C中药品充分反应后,关闭A的活塞,停止加热。冷却后,称量D的质量为m2 g。 实验进行的过程中,装置C中发生的主要化学反应类型 ;充分反应后装置C中剩余的固体成分是 。
(3)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使C中反应完全,D中吸收完全,也不会得出正确的结果。经讨论,有同学提出在B与C之间加入一个装置,该装置作用是 。
(4)有学生提出直接用右图装置,在空气中直接加热进行实验。

图中仪器“a”的名称为 。
若取20g铜粉(含炭)样品进行实验,充分反应后,仪器a中剩余的固体质量为24g,计算求原来混合物中铜的物质的量以及铜的质量分数。
(要求:根据化学方程式计算,并写出计算过程!)

仪器:铁架台(含铁圈、铁夹)、分液漏斗、平底烧瓶、硬质玻璃管、干燥管、酒精灯、石棉网、洗气瓶等。
药品:红褐色(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰(固体氢氧化钠和氧化钙的混合物,可用来吸收水和CO2)。
(1)除上述仪器外,实验中还必须用到的仪器是 ;
(2)实验操作前,首先进行 检查。在C中加入样品粉末W g,D中装入药品后并称量为m1 g,连接好仪器。打开A的上塞、活塞,慢慢滴加溶液。对C进行加热。当C中药品充分反应后,关闭A的活塞,停止加热。冷却后,称量D的质量为m2 g。 实验进行的过程中,装置C中发生的主要化学反应类型 ;充分反应后装置C中剩余的固体成分是 。
(3)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使C中反应完全,D中吸收完全,也不会得出正确的结果。经讨论,有同学提出在B与C之间加入一个装置,该装置作用是 。
(4)有学生提出直接用右图装置,在空气中直接加热进行实验。

图中仪器“a”的名称为 。
若取20g铜粉(含炭)样品进行实验,充分反应后,仪器a中剩余的固体质量为24g,计算求原来混合物中铜的物质的量以及铜的质量分数。
(要求:根据化学方程式计算,并写出计算过程!)
(1)天平
(2)气密性 化合反应 氧化铜
(3)干燥
(4)蒸发皿 96%
(2)气密性 化合反应 氧化铜
(3)干燥
(4)蒸发皿 96%
试题分析:实验目的:对获得的铜粉(含炭)样品进行实验,测定铜的质量分数。所以需要用天平来称量固体的质量,为了得出准确的结论,精确的测量生成二氧化碳的质量,装置需具有良好的气密性。装置C中发生的主要化学反应为碳和氧气生成二氧化碳,铜和氧气生成氧化铜,所以化学反应类型为化合反应,充分反应后装置C中剩余的固体成分是氧化铜。为了排除水蒸气的而影响造成D装置测量值偏大,需在B与C之间加入一个干燥装置。在化学反应中各物质质量成比例,可根据化学方程计算生成24g氧化铜所需铜的质量,从而计算出原混合物中铜的物质的量以及铜的质量分数。
解:设生成硫酸铜质量为x克
2Cu+O2
 2CuO
2CuO128 160
X 24
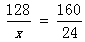
x=19.2
n(Cu)=19.2/64=0.3mol
铜的质量分数=19.2/20=0.96=96%

练习册系列答案
相关题目
