题目内容
研究物质的性质和变化是认识物质的重要手段.请根据反应事实写出下列反应的化学方程式,并回答有关问题.(1)细铁丝在氧气中燃烧
(2)红磷在空气中燃烧
(3)有水生成的化合反应
(4)煅烧石灰石制生石灰和二氧化碳:
(5)常温下实验室制取氧气
(6)某些物质溶于水电离出自由移动的
分析:只有熟悉质量守恒定律的两个原则、化学方程式的书写方法、化学变化中的能量变化、电离、溶液的导电性、溶液的电中性,才能得出本题正确的答案.
解答:解:(1)铁与氧气在点燃条件下反应生成四氧化三铁.
该反应的化学方程式为:3Fe+2O2
Fe3O4.
(2)磷与氧气在点燃条件下反应生成五氧化二磷.
该反应的化学方程式为:4P+5O2
2P2O5.
(3)氢气和氧气在点燃条件下反应生成水.
该反应生成了水,反应中由两种物质反应生成一种物质,符合化合反应的概念.
该反应的化学方程式为:2H2+O2
2H2O.
(4)石灰石的主要成分是碳酸钙,生石灰的主要成分是氧化钙,碳酸钙在高温条件下反应生成氧化钙和二氧化碳.
该反应的化学方程式为:CaCO3
CaO+CO2↑.
该反应过程中需要向反应提供热量,因此该反应是吸热反应.
(5)实验室制取氧气的原理中只有用过氧化氢制取氧气是在常温下进行的,该反应中,过氧化氢在二氧化锰的催化作用下反应生成水和氧气.
该反应的化学方程式为:2H2O2
2H2O+O2↑.
(6)溶液能导电是因为物质溶于水时物质在水分子的作用下电离出了离子.
氯化钠溶液中存在的离子是钠离子和氯离子.1个钠离子含有1个钠原子且带有1个单位的正电荷,钠原子用钠的元素符号Na表示,表示离子所带电荷数的数字写在元素符号的右上角,且数字在前,正负号在后,因此钠离子的符号是Na-;1个氯离子含有1个氯原子且带有1个单位的负电荷,氯原子用氯的元素符号Cl表示,表示离子所带电荷数的数字写在元素符号的右上角,且数字在前,正负号在后,因此氯离子的符号是Cl-.
由于氯化钠溶液中钠离子和氯离子所带的正、负电荷总数相等,因此氯化钠溶液不显电性.
故答案为:
(1)3Fe+2O2
Fe3O4
(2)4P+5O2
2P2O5
(3)2H2+O2
2H2O
(4)CaCO3
CaO+CO2↑;放热
(5)2H2O2
2H2O+O2↑
(6)离子;Na+、Cl-;溶液中各离子所带的正、负电荷总数相等
该反应的化学方程式为:3Fe+2O2
| ||
(2)磷与氧气在点燃条件下反应生成五氧化二磷.
该反应的化学方程式为:4P+5O2
| ||
(3)氢气和氧气在点燃条件下反应生成水.
该反应生成了水,反应中由两种物质反应生成一种物质,符合化合反应的概念.
该反应的化学方程式为:2H2+O2
| ||
(4)石灰石的主要成分是碳酸钙,生石灰的主要成分是氧化钙,碳酸钙在高温条件下反应生成氧化钙和二氧化碳.
该反应的化学方程式为:CaCO3
| ||
该反应过程中需要向反应提供热量,因此该反应是吸热反应.
(5)实验室制取氧气的原理中只有用过氧化氢制取氧气是在常温下进行的,该反应中,过氧化氢在二氧化锰的催化作用下反应生成水和氧气.
该反应的化学方程式为:2H2O2
| ||
(6)溶液能导电是因为物质溶于水时物质在水分子的作用下电离出了离子.
氯化钠溶液中存在的离子是钠离子和氯离子.1个钠离子含有1个钠原子且带有1个单位的正电荷,钠原子用钠的元素符号Na表示,表示离子所带电荷数的数字写在元素符号的右上角,且数字在前,正负号在后,因此钠离子的符号是Na-;1个氯离子含有1个氯原子且带有1个单位的负电荷,氯原子用氯的元素符号Cl表示,表示离子所带电荷数的数字写在元素符号的右上角,且数字在前,正负号在后,因此氯离子的符号是Cl-.
由于氯化钠溶液中钠离子和氯离子所带的正、负电荷总数相等,因此氯化钠溶液不显电性.
故答案为:
(1)3Fe+2O2
| ||
(2)4P+5O2
| ||
(3)2H2+O2
| ||
(4)CaCO3
| ||
(5)2H2O2
| ||
(6)离子;Na+、Cl-;溶液中各离子所带的正、负电荷总数相等
点评:本题主要考查质量守恒定律的两个原则、化学方程式的书写方法、化学变化中的能量变化、电离、溶液的导电性、溶液的电中性,难度稍大.

练习册系列答案
相关题目
 表示氧原子、
表示氧原子、 表示碳原子,则请回
表示碳原子,则请回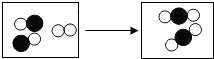
 表示氧原子、
表示氧原子、 表示碳原子,则该反应的化学方程式为:
表示碳原子,则该反应的化学方程式为: