题目内容
为测定一瓶敞口放置的浓盐酸的溶质的质量分数,某同学量取20 mL(密度为1.1 g/mL)的该盐酸与大理石充分反应,共用去含碳酸钙85%的大理石7.1 g。
(1)浓盐酸需要密封保存的原因是_______________________________________。
(2)计算该盐酸的溶质质量分数。
答案:(1)浓盐酸易挥发
(2)解:设该盐酸中溶质的质量为x。
CaCO3 + 2HCl===CaCl2+H2O+CO2↑
100 73
7.1 g×85% x
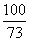 =
=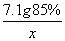
x≈4.4 g
盐酸的溶质质量分数=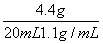 ×100%=20%
×100%=20%
答:该盐酸的溶质质量分数为20%。

练习册系列答案
相关题目