题目内容
A、B、C、D均是元素周期表中原子序数为1-18之间的常见元素。其中A原子是由一个质子和一个电子构成的;B元素组成的单质是空气中含量最多的物质;C2-与D3+的结构
示意图均可表示为 。由此请回答下列问题:
(1)写出下列元素符号:A B ;
(2)C2-核内质子数是__________ ,D原子的结构示意图可表示为_______________;
(3)写出A元素与C元素组成的一种纯净物的化学符号_________________。
(5分)(1)H N ;(2)8 , (3) H2O或H2O2

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
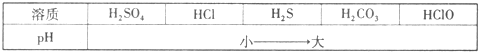
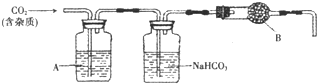
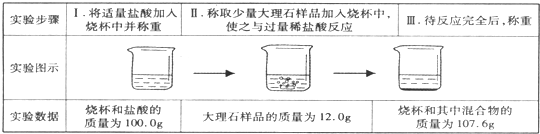
 如图是氢气和氯气反应的微观示意图,下列说法中不正确的是( )
如图是氢气和氯气反应的微观示意图,下列说法中不正确的是( )

