题目内容
【题目】Na2SO4是制造纸张、药品、染料稀释剂等的重要原料。某Na2SO4样品中含有少量CaCl2和MgCl2,实验室提纯Na2SO4的流程如图所示。
(1)加入NaOH溶液可除去的阳离子是_______(填离子符号),其反应的化学方程式为____________。若添加的NaOH溶液和Na2CO3溶液过量,可加入适量_______ (填名称)除去。
(2)操作a的名称是_______,该操作中需要用到的玻璃仪器有烧杯、玻璃棒、_______。
(3)溶液M中的溶质是Na2SO4和杂质NaCl,观察溶解度曲线,则操作b是:先将溶液M蒸发浓缩,再降温结晶、过滤。降温结晶的最佳温度范围是(______)
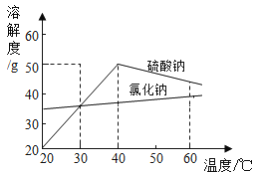
A.40℃以下 B.30℃以下 C.40℃以上
这是因为Na2SO4的溶解度_______________________________。
【答案】 Mg2+ MgCl2 + 2NaOH = 2NaCl + Mg(OH)2↓ 稀硫酸 过滤 漏斗 B 30℃以下比NaCl小 或30℃以下受温度影响比NaCl大
【解析】(1)加入的氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,因此除去的是镁离子,反应的化学方程式分别为:2NaOH+MgCl2═Mg(OH)2↓+2NaCl;稀硫酸和氢氧化钠反应生成硫酸钠和水,没有带入新杂质;碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳气体,没有带入任何其它杂质;符合除杂的原则,故NaOH和Na2CO3如果添加过量了,可在过滤后向滤液中滴加稀硫酸除去;
(2)操作a得到的是固体和液体,因此是过滤,过滤需要烧杯、玻璃棒、漏斗、铁架台;
(3)降温结晶的最佳温度范围是30℃以下,即答案为C;由于硫酸钠的溶解度在30℃以下比氯化钠小,降温的过程中会析出大量的硫酸钠。