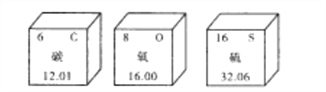
题目内容
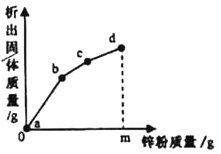
【题目】甲、乙两中固体物质(均不含结晶水)的溶解度曲线如图所示,下列说法错误的是
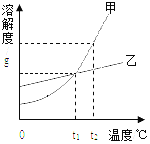
A. t2℃时,将甲、乙的两种饱和溶液分别降温到t1℃,所得溶液都是饱和溶液
B. 甲中混有少量乙时,可用降温结晶的方法提纯甲
C. t2℃时,将等质量的甲、乙两种溶液分别降温到0℃,溶质质量分数:甲<乙
D. t1℃时,20g甲的饱和溶液、15g乙的饱和溶液中,甲和乙的溶解度不相等
【答案】CD
【解析】根据所学知识和题中信息知,A、甲、乙两种物质溶解度均是随温度升高而增大,t2℃时,将甲、乙的两种饱和溶液分别降温到t1℃,所得溶液都是饱和溶液,故A正确;B、甲物质溶解度随温度升高而增大,、乙物质溶解度随温度升高而变化不大,甲中混有少量乙时,可用降温结晶的方法提纯甲,故B正确;C、t2℃时甲物质溶解度大于乙,0℃时乙物质溶解度大于甲,t2℃时,将等质量的甲、乙两种饱和溶液分别降温到0℃,溶质质量分数:甲<乙,如果甲、乙两种物质溶液不饱和,就无法确定,故C错误;D、t1℃时,甲、乙两种物质溶解度曲线相交于一点,说明此时溶解度相等,20g甲的饱和溶液、15g乙的饱和溶液中,甲和乙的溶解度相等,故D错误。
点睛∶溶解度曲线的意义①表示同一种物质在不同温度时的溶解度或溶解度随温度变化的情况;②表示不同物质在同一温度时的溶解度,可以比较同一温度时,不同物质的溶解度的大小。若两种物质的溶解度曲线相交,则在该温度下两种物质的溶解度相等;③根据溶解度曲线可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法;④根据溶解度曲线能进行有关的计算。

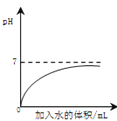
【题目】下列四个图像反映了对应实验过程中相关量的变化,其中错误的是
|
|
|
|
A.部分变质的NaOH溶液中滴加稀盐酸 | B.HCl气体的溶解度受温度影响的变化曲线 | C.等质量的Mg粉和Fe粉与足量相同浓度的稀盐酸反应 | D.硫酸溶液稀释过程中pH的变化曲线 |
A. A B. B C. C D. D
【题目】把A、B、C、D四种物质放在密闭容器中,在一定条件下充分反应,并测得反应物和产物在反应前后各物质的质量如表所示:
物质 | A | B | C | D |
反应前质量 |
|
|
|
|
反应后质量 | 待测 |
| 0 |
|
下列说法正确的是![]()
A. 物质C一定是反应物,物质D可能是单质
B. 反应后密闭容器中A的质量为![]()
C. 反应过程中,物质B和物质D变化的质量比为87:36
D. 若物质A与物质C的相对分子质量之比为194:216,则反应中A和C的化学计量数之比为2:1