题目内容
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,转化流程如下图所示:
![]()
已知MFe2Oy中Fe为+3价。下列说法中,正确的是
A. y的数值为5 B. SO2不是该反应的催化剂
C. MFe2Ox发生了分解反应 D. 该过程是物理变化
【答案】B
【解析】A.根据化学式中各元素正负化合价代数和为0解答;
B. 根据催化剂在化学反应前后质量和化学性质都不发生变化分析;
C. 根据分解反应的特征进行分析判断;
D.根据是否有新物质生成判断。
解:A. 已知MFe2Oy中Fe为+3价,M表示+2价的金属元素,O显-2价。则+2+(+3×2)+(-2)×y=0。则y=4。故错误;
B. 由转化流程图、题意可知,常温下,MFe2Ox能使工业废气中的SO2转化为S,可判断SO2参与了反应,是反应物,不是该反应的催化剂,故选项说法正确;
C.因为分解反应一种化合物在特定条件下(如加热、通直流电、催化剂等)分解成二种或二种以上较简单的单质或化合物的反应.而此反应不符合该特征.故说法错误;
D.由题意可知,MFe2Ox能使工业废气中的SO2转化为S,有新物质S生成。故属于化学变化。错误;

【题目】某小组同学用不同长度的光亮镁条分别与4 mL 5%的稀盐酸反应,实验现象记录如下。
试管 | A | B | C | D |
镁条长度 | 1 cm | 2 cm | 3 cm | 4 cm |
实验现象 | 产生大量气泡,镁条溶解 | |||
无沉淀 | 少量灰白色沉淀 | 较多量灰白色沉淀 | 大量灰白色沉淀 | |
【提出问题】灰白色沉淀是什么?实验中为什么出现了灰白色沉淀?
【查阅资料】氢氧化镁[Mg(OH)2]难溶于水,Mg(OH)2 ![]() MgO + H2O
MgO + H2O
【猜想与假设】
Ⅰ. 灰白色沉淀可能是析出的氯化镁。
Ⅱ. 灰白色沉淀可能是生成的氢氧化镁。
【进行实验】
实验 | 实验操作 | 实验现象 |
1 | ① 取一定量上述实验中灰白色沉淀放入试管中,然后加入 5mL 蒸馏水,振荡、静置 ② 取等量氯化镁固体放入另一支试管中,加5mL蒸馏水,振荡 | ① 中固体量未减少 ② 中固体全部溶解得到澄清溶液 |
2 | 取上述实验中灰白色沉淀,用蒸馏水洗涤、室温晾干,放入试管中进行加热,试管口用湿润的紫色石蕊试纸检验 | 紫色石蕊试纸变红 |
3 | ① 在1支试管放入一小段光亮的镁条,加入 5mL 蒸馏水 ② 再向试管中加入几滴氯化镁饱和溶液 | ① 中无明显现象 ② 中镁条表面立即持续产生细小气泡并不断溶解,一段时间后镁条全部溶解,有大量灰白色沉淀 |
实验4:测定反应过程中溶液的pH变化。
在小烧杯中放入约 50 mL 质量分数为0.5% 稀盐酸,然后加入10 cm 光亮的镁条,现象及数据如下表所示。
时间/min | 0 | 48 | 77 | 85 | 87 | 95 | 100 |
溶液pH | 2 | 3 | 5.2 | 7.2 | 8.6 | 9.1 | 10.6 |
实验现象 | 大量气泡 | 镁条表面变暗,气泡减小 | 镁条表面变灰,有沉淀生成,并逐渐增多 | ||||
【解释与结论】
(1)试管A中,镁与稀盐酸反应的化学方程式为_______。
(2)猜想与假设Ⅰ不成立,其原因是_______。
(3)根据上述实验得出的下列结论中,正确的是________(填序号)。
A.灰白色固体不是氢氧化镁
B.镁条的用量偏多导致沉淀产生
C.灰白色固体受热产生酸性物质
(4)根据实验4,你认为产生灰白色沉淀的条件是________。
【反思与评价】
(5)经过进一步实验,灰白色沉淀中含有镁、氯、氢、氧四种元素。实验3中产生灰白色沉淀是因为镁与________反应生成的。
(6)通过本实验,今后再遇到化学反应中的异常现象时,可以从______角度分析原因(答出一条即可)。
【题目】九年级(三)班化学兴趣小组为测定大理石中碳酸钙的含量,如下图所示:
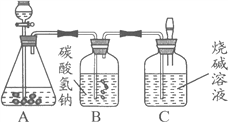
将过量的稀盐酸加入到20 g大理石中(其他成分不与盐酸反应),把产生的CO2气体用足量的烧碱溶液吸收,同时测量C瓶烧碱溶液增加的质量,结果如下表所示:
时间 / 分 | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
C增加质量/C | 0 | 3.0 | 5.0 | 6.0 | 6.6 | x | 6.6 |
(1)上表中,第10分钟时,x= 。
(2)计算大理石样品中碳酸钙的质量分数。
(3)请在下图的坐标纸上,以时间为横坐标,以产生CO2气体的质量为纵坐标,画出能够表明产生气体的质量随时间变化规律的关系曲线;
(4)B中所装药品为碳酸氢钠溶液,作用是吸收可能挥发的HCl气体,你认为对测量结果有没有影响? (填“有”或“没有”)