题目内容
 金属在生产和生活中有广泛的应用.
金属在生产和生活中有广泛的应用.
(1)如图是家用的台灯.图中标示的物质中,属于金属材料的有______(填序号),其中铜制插头利用金属铜的
______性.
(2)为防止铁螺丝钉生锈,常在其表面镀一层铬.镀铬能防锈的原因是______.
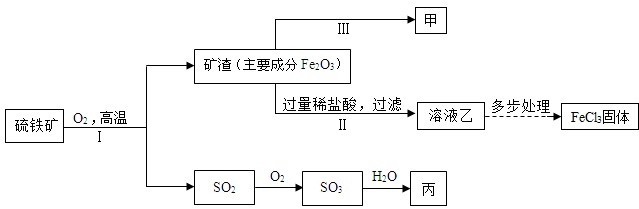
(3)硫铁矿【主要成分是二硫化亚铁(FeS2)】是一种重要的化工原料,常用来制备铁、硫酸和氯化铁,其工业流程示意图如下.

【资料】Fe+2FeCl3=3FeCl2
①Ⅱ中反应的化学方程式是______.Ⅲ中反应的化学方程式是______.
②结合上述流程,下列说法不正确的是______(填序号).
a.反应Ⅰ的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
b.上述流程所涉及的物质中,硫元素的化合价有-2.+4.+6
c.若向溶液乙和丙的稀溶液中分别加入足量的甲,会观察到完全相同的现象
d.假设转化过程中无损失,150t含FeS280%的硫铁矿最多可以制得98t硫酸.
解:(1)金属材料包括金属单质和金属合金,所以①②④属于金属材料,由于金属铜具有良好的导电性,所以常用于导线和插头;
(2)铁生锈的条件是存在氧气和水的环境,在其表面镀一层铬可有效地防止水和氧气与铁的接触,从而起到防锈的作用;
(3)①II是氧化铁和盐酸的反应,方程式为:Fe2O3+6HCl=2FeCl3+3H2O;由于该过程是生成铁、氯化铁和硫酸的过程,由图示分析可知甲应该是金属铁,所以III的反应可以是:3CO+Fe2O3 2Fe+3CO2;
2Fe+3CO2;
②a、由于I是二硫化亚铁和氧气的反应,方程式为4FeS2+11O2 2Fe2O3+8SO2;
2Fe2O3+8SO2;
b、上述流程所涉及的物质中含硫的物质分别是FeS2、SO3、SO2,化合价分别是-1、+6、+4;
c、由图示可知乙的溶液是氯化铁,丙是硫酸溶液,铁的放入会导致发生Fe+2FeCl3=3FeCl2,和铁置换出硫酸中的氢从而生成氢气的过程,所以显现不可能相同;
d、假设转化过程中无损失,则硫元素的质量相同,故150t含FeS280%的硫铁矿最多可以制得硫酸的硫酸的质量是x.
FeS2~2H2SO4
120 196
150t x

x=245t
故选bcd
故答案为:(1)①②④;导电;(2)隔绝了潮湿的空气;(3)①Fe2O3+6HCl=2FeCl3+3H2O;3CO+Fe2O3 2Fe+3CO2;
2Fe+3CO2;
②bcd;
分析:(1)依据金属材料包含金属单质与合金以及金属的导电性分析解答;
(2)依据金属生锈的条件分析防锈的方法;
(3)①依据氧化铁能与盐酸反应生成氯化铁和水以及氧化铁与一氧化碳反应生成铁和二氧化碳的过程书写方程式即可;
②a、依据反应过程和方程式的书写要求判断方程式的正确性;
b、依据过程中涉及到的硫的化合物情况分析硫的化合价;
c、依据反应的具体情况分析解答;
d、依据化学方程式的有关计算分析解答;
点评:此题是对铁的有关知识的考查,解题的关键是对铁的冶炼、防锈以及化学用语的理解和掌握;
(2)铁生锈的条件是存在氧气和水的环境,在其表面镀一层铬可有效地防止水和氧气与铁的接触,从而起到防锈的作用;
(3)①II是氧化铁和盐酸的反应,方程式为:Fe2O3+6HCl=2FeCl3+3H2O;由于该过程是生成铁、氯化铁和硫酸的过程,由图示分析可知甲应该是金属铁,所以III的反应可以是:3CO+Fe2O3
 2Fe+3CO2;
2Fe+3CO2;②a、由于I是二硫化亚铁和氧气的反应,方程式为4FeS2+11O2
 2Fe2O3+8SO2;
2Fe2O3+8SO2;b、上述流程所涉及的物质中含硫的物质分别是FeS2、SO3、SO2,化合价分别是-1、+6、+4;
c、由图示可知乙的溶液是氯化铁,丙是硫酸溶液,铁的放入会导致发生Fe+2FeCl3=3FeCl2,和铁置换出硫酸中的氢从而生成氢气的过程,所以显现不可能相同;
d、假设转化过程中无损失,则硫元素的质量相同,故150t含FeS280%的硫铁矿最多可以制得硫酸的硫酸的质量是x.
FeS2~2H2SO4
120 196
150t x

x=245t
故选bcd
故答案为:(1)①②④;导电;(2)隔绝了潮湿的空气;(3)①Fe2O3+6HCl=2FeCl3+3H2O;3CO+Fe2O3
 2Fe+3CO2;
2Fe+3CO2;②bcd;
分析:(1)依据金属材料包含金属单质与合金以及金属的导电性分析解答;
(2)依据金属生锈的条件分析防锈的方法;
(3)①依据氧化铁能与盐酸反应生成氯化铁和水以及氧化铁与一氧化碳反应生成铁和二氧化碳的过程书写方程式即可;
②a、依据反应过程和方程式的书写要求判断方程式的正确性;
b、依据过程中涉及到的硫的化合物情况分析硫的化合价;
c、依据反应的具体情况分析解答;
d、依据化学方程式的有关计算分析解答;
点评:此题是对铁的有关知识的考查,解题的关键是对铁的冶炼、防锈以及化学用语的理解和掌握;

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目

 (2013?玄武区二模)金属在生产和生活中有广泛的应用.
(2013?玄武区二模)金属在生产和生活中有广泛的应用. (2013?西城区二模)金属在生产和生活中有广泛的应用.
(2013?西城区二模)金属在生产和生活中有广泛的应用.