题目内容
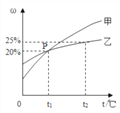
【题目】向一定量Ba(OH)2的溶液中加入稀H2SO4溶液,与反应有关的变化关系用下图表示,其中错误的是

A. A B. B C. C D. D
【答案】B
【解析】A、Ba(OH)2的溶液呈碱性,开始溶液的pH大于7,随反应的进行氢氧化钡逐渐减少,pH变小,刚好完全反应时pH=7;酸过量时,pH小于7.图像正确;B、氢氧化钡最终能被反应完,最后氢氧化钡的质量为零,B错误;C、Ba(OH)2的溶液中加入稀H2SO4溶液,随反应的进行,生成物硫酸钡逐渐增多,氢氧化钡被反应完,硫酸钡的质量达到最大值,并不再改变,C正确;溶液中的导电微粒是溶液中自由的离子,反应中离子逐渐减少,所以导电性逐渐变小,刚好完全反应时只有沉淀和水,没有离子,导电性为零,酸过量后,溶液中的又有了氢离子和硫酸根离子,并不断增多,所以导电性又逐渐增强。D正确;选B

 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】为探究氢氧化钙溶液和稀盐酸反应所得溶液中溶质的成分,小鸣和同学们通过测定了反应后溶液的pH,得到了如下图所示的pH曲线,请回答:
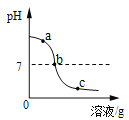
(1)由图可知该实验操作是将__________滴加到另一种溶液中;
(2)该反应的化学方程式为___________;
(3)实验过程中,小鸣取了a、b、c三处反应后的溶液于三个烧杯中,却忘了作标记,请你设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液。
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3=CaCO3↓+2NaCl。
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现___________的现象。结论:该样品是a处溶液。
②为进一步确定b或c处溶液,又设计了以下方案:
实验步骤 | 实验现象 | 实验结论 |
另取余下样品少量于两支试管中,分别滴加足量的Na2CO3溶液。 | ________ | 该样品为b处溶液。 |
【反思评价】探究反应后溶液中溶质的成分,除了要考虑生成物之外,还要考虑____________。
【题目】某兴趣小组用如图所示装置制取氧气,试管中固体的质量随时间变化的数据见下表。制取结束后,将剩余固体用适量水充分溶解后,过滤,回收二氧化锰固体,并得到氯化钾不饱和溶液100g。

加热时间/min | 0 | t1 | t2 | t3 |
固体质量/g | 28.0 | 23.2 | 18.4 | 18.4 |
(1)共制得氧气 g。
(2)计算所得氯化钾溶液的溶质质量分数。