题目内容
(2010?威海)为了测定某赤铁矿石中氧化铁的质量分数,取矿石样品40g,加入盐酸,恰好完全反应时,共用去盐酸219g,过滤、洗涤、干燥后得滤渣8g(矿石中的杂质既不溶于水也不与盐酸反应).计算:(1)赤铁矿石中氧化铁的质量分数;
(2)盐酸的溶质质量分数.
【答案】分析:矿石中的杂质既不溶于水也不与盐酸反应,则矿石反应后固体减少的质量为矿石中氧化铁的质量;根据氧化铁与盐酸反应的化学方程式,由反应消耗氧化铁的质量计算出参加反应的HCl的质量,然后利用 ×100%计算出所使用盐酸的溶质质量分数.
×100%计算出所使用盐酸的溶质质量分数.
解答:解:(1)氧化铁的质量为40g-8g=32g
赤铁矿石中氧化铁的质量分数= =80%
=80%
(2)设盐酸中溶质的质量为x
6HCl+Fe2O3=2FeCl3+3H2O
219 160
x 32g
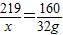
x=43.8g
盐酸的质量分数= =20%
=20%
答:(1)赤铁矿石中氧化铁的质量分数为80%;
(2)盐酸的溶质质量分数为20%.
点评:化学方程式与溶液相结合的计算,根据化学方程式进行计算时,代入计算的物质质量应为纯净物的质量.
 ×100%计算出所使用盐酸的溶质质量分数.
×100%计算出所使用盐酸的溶质质量分数.解答:解:(1)氧化铁的质量为40g-8g=32g
赤铁矿石中氧化铁的质量分数=
 =80%
=80%(2)设盐酸中溶质的质量为x
6HCl+Fe2O3=2FeCl3+3H2O
219 160
x 32g
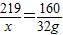
x=43.8g
盐酸的质量分数=
 =20%
=20%答:(1)赤铁矿石中氧化铁的质量分数为80%;
(2)盐酸的溶质质量分数为20%.
点评:化学方程式与溶液相结合的计算,根据化学方程式进行计算时,代入计算的物质质量应为纯净物的质量.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目