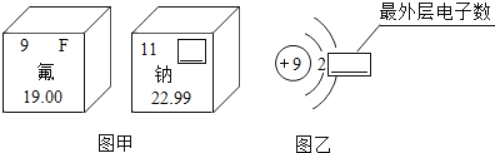
题目内容
【题目】化学基础与常识
(1)下图金属应用的实例,主要利用金属的导热性的是_______(填序号);

A电缆 B.电热壶 C.金属丝 D.金属乐器
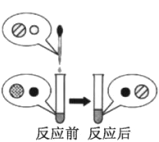
(2)向氢氧化钠溶液中滴加稀盐酸至恰好完全反应,反应前后溶液中存在的离子种类如图所示(其中“○”“![]() ”“●”“
”“●”“ ![]() ”表示不同离子)。则“○”与“
”表示不同离子)。则“○”与“![]() ”反应生成了_________(填物质名称)。
”反应生成了_________(填物质名称)。
(3)氢氟酸(HF)能刻画玻璃,其中有一个化学反应的化学方程式是:CaSiO3+6HF=X+SiF4↑+3H2O,则X的化学式为_______________
(4)氢能是一种极具发展潜力的清洁能。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示。
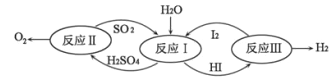
写出反应I中,发生反应的化学方程式:_____________________________。
【答案】 B 水 CaF2 SO2+I2+2H2O=H2SO4+2HI
【解析】(1) A、电缆是利用金属的导电性,故错误;B、电热壶利用金属的导热性,故正确;C、金属丝利用金属的延展性,故错误;D、金属乐器利用金属具有金属光泽、硬度大,故错误;(2) 氢氧化钠与稀盐酸反应生成氯化钠和水,中和反应的实质是氢离子和氢氧根离子结合生成水分子;(3)在化学反应CaSiO3+6HF=X+SiF4↑+3H2O中,反应前后原子的数目、种类都不变;反应前有6个氢原子、6个氟原子、1个硅原子、3个氧原子、1个钙原子;反应后除X外有6个氟原子、1个硅原子、6个氢原子、3个氧原子,因此每个X分子中应该有2个氟原子和1个钙原子,故X的化学式为CaF2;(4)据图可知,反应I中是由SO2、I2和2H2O生成H2SO4和2HI,反应的化学方程式:SO2+I2+2H2O=H2SO4+2HI。