题目内容
【题目】家里厨房中使用的食用碱(主要成分碳酸钠)中往往含有少量的氯化钠,某化学兴趣小组的同学通过实验来测定某品牌的食用碱样品中碳酸钠的质量分数。他们实验的过程和数据如图所示。
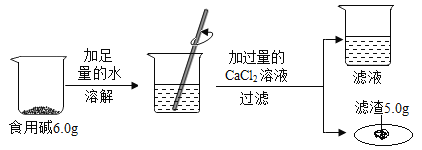
(1)该反应的化学方程式是_____;
(2)加入过量的CaCl2溶液的目的是_____;
(3)计算:该食用碱中碳酸钠的质量分数是______?(计算结果精确至0.1%)
【答案】CaCl2+Na2CO3═CaCO3↓+2NaCl 使碳酸钠完全反应 88.3%
【解析】
(1)根据碳酸钠能与氯化钙反应生成碳酸钙沉淀和氯化钠分析;
(2)根据碳酸钠能与氯化钙反应分析;
(3)根据化学方程式以及图片提供的数据进行分析解答即可。
(1)碳酸钠能与氯化钙反应生成碳酸钙沉淀和氯化钠,化学方程式为:CaCl2+Na2CO3═CaCO3↓+2NaCl;
(2)实验中加入过量CaCl2溶液的目的是使碳酸钠完全反应;
(3)生成碳酸钙沉淀的质量为5.0g,设该食用碱中碳酸钠的质量分数为x,
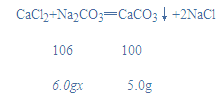
![]()
x≈88.3%;
答:该食用碱中碳酸钠的质量分数为88.3%。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目