题目内容
【题目】现有A、B两种银白色的金属,某同学想要探究这两种金属的活动性
(设计实验)
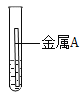
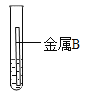
取大小相同的两块金属,用砂纸打磨光亮,分别放入两支试管中再加入等量的同种稀盐酸,操作与现象如表:
实验 | 试管1 | 试管2 |
操作 |
|
|
现象 | 金属表面产生气泡较慢 | 金属表面产生气泡较快 |
(思考结论)
(1)通过上述实验,判断出两种金属的活动性顺序是A _____B(填“>”或“<”)。
(2)假设金属B是铝,写出其中发生反应的化学方程式_____。
(3)实验前用砂纸打磨金属片的目的是_____。
【答案】< 2Al+6HCl═2AlCl3+3H2↑ 除去金属表面的氧化膜或污物,利于反应进行
【解析】
(1)试管1中金属表面产生气泡较慢,试管2中金属表面产生气泡较快,判断出两种金属的活动性顺序是A<B。
(2)铝和稀盐酸反应生成氯化铝(AlCl3)和氢气,反应的化学方程式为:2Al+6HCl═2AlCl3+3H2↑。
(3)金属的表面可能有与氧气反应生成的氧化物或污物,用砂纸打磨金属片,其目的是除去金属表面的氧化膜,利于反应进行。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目