题目内容
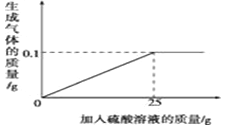
【题目】现有家庭食用碱样品12g(主要成分Na2CO3,其它成分不与酸反应),向其中加入某未知浓度的盐酸,生成气体的质量与加入盐酸的质量关系如图。
请计算:
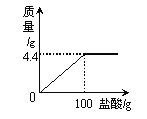
(1)食用碱中碳酸钠的纯度是多少?
(2)盐酸的溶质的质量分数是多少?(要求写出计算过程,结果精确到0.1)
【答案】(1)88.3%;(2)7.3%
【解析】
试题分析:食用碱中碳酸钠的纯度=碳酸钠的质量/样品质量×100%,盐酸的溶质的质量分数=氯化氢的质量/盐酸的质量×100%,样品质量为12g,参与反应的盐酸质量为100g,因此由题结合方程式碳酸钠与盐酸生成氯化钠、水、二氧化碳,和已知生成物二氧化碳的质量4.4g求出碳酸钠的质量和氯化氢的质量,代入式子可得质量分数;解:设食用碱中碳酸钠的质量为x,参与反应的HCl质量为y。
Na2CO3 + 2HCl = 2NaCl + CO2 ↑ + H2O
106 73 44
x y 4.4g
106/x=73/y=44/4.4g
X =10.6 g
y = 7.3 g
碳酸钠的纯度 = 10.6g/12g×100% =88.3%
盐酸的溶质质量分数 = 7.3g/100g×100%=7.3%
答:食用碱中碳酸钠的纯度是88.3%,盐酸的溶质质量分数为7.3%。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目