题目内容
【题目】铁是常用的金属材料。兴趣小组的同学对某铁制品中铁的质量分数进行了测定。 称取3 g铁屑,缓慢加入一定溶质质量分数的硫酸溶液,直到过量(假设除铁以外的物质都不与硫酸反应),实验数据如图所示。 请计算:
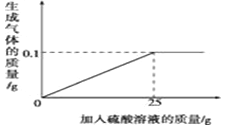
(1)该铁制品中铁的质量分数(最终结果保留到0.1%);
(2)所用硫酸溶液的溶质质量分数。
(要求有计算的过程) (3)恰好完全反应时所得溶液的质量为多少?
【答案】(1)93.3%;(2)19.6%;(3)27.7g;
【解析】
试题分析:由题图知,反应中生成氢气的质量为0.1 g,恰好完全反应时消耗硫酸溶液的质量为25 g。
设3 g铁屑中含铁的质量为x,参加反应的硫酸的质量为y。
Fe+H2SO4===FeSO4+H2↑
56 98 2
x y 0.1 g
56/x=2/0.1g , x=2.8 g
则铁制品中含铁的质量分数=2.8g/3×100%≈93.3%
98/y=2/0.1g , y=4.9 g
则硫酸溶液的溶质质量分数=4.9g/25g×100%=19.6%
恰好完全反应所得溶液的质量=2.8g+25g-0.1g=27.7g
答:该铁制品中铁的质量分数约为93.3%,所用硫酸溶液的溶质质量分数为19.6%,恰好完全反应时所得溶液的质量为27.7g.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目