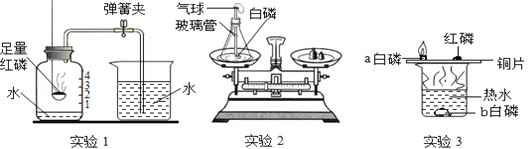
题目内容
【题目】根据质量守恒定律回答下列问题:
(1)加热24.5gKClO和2gMnO的混合物,充分反应后,剩余固体的质量为16.9g,则产生氧气的质量为_______g。
(2)浓硝酸分解反应的化学方程式为:4HNO![]() 2HO+4NO↑+X↑。回答下列问题:
2HO+4NO↑+X↑。回答下列问题:
推断X的化学式是______,推断X化学式的依据是___________________________,此反应的基本反应类型属于______。
【答案】 9.6 O 化学反应前后原子种类数目不变 分解反应
【解析】本题考查了质量守恒定律的运用。
(1)根据质量守恒定律可知,产生氧气的质量=24.5g+2g-16.9=9.6g;
(2)根据质量守恒定律可知化学反应前后原子种类数目不变,由反应4HNO![]() 2HO+4NO↑+X↑,反应前4HNO3中含H、N、O原子个数分别为4、4、12,而反应后2H2O、4NO2中共含有H、N、O原子个数分别为4、4、10,根据反应前后原子种类、个数不变,可判断X分子由2个O原子构成,物质X的化学式为O2,此反应是由一种物质生成三种物质,属于分解反应。
2HO+4NO↑+X↑,反应前4HNO3中含H、N、O原子个数分别为4、4、12,而反应后2H2O、4NO2中共含有H、N、O原子个数分别为4、4、10,根据反应前后原子种类、个数不变,可判断X分子由2个O原子构成,物质X的化学式为O2,此反应是由一种物质生成三种物质,属于分解反应。

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案【题目】铁、铝、铜是常见的三种金属。同学们发现生活中的铝和铜制品表面一般不用防锈,而铁制品一般需要做防锈处理。
【提出问题】这是不是因为铁、铝、铜三种金属中铁的活动性最强呢?
【实验探究】同学们对这三种金属的活动性顺序展开了探究,请你参与探究并填写空格。
将粗细相同的铁丝、铝丝、铜丝分别插入体积相同、溶质质量分数也相同的稀盐酸中:
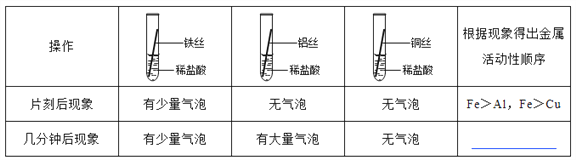
__________________
【讨论交流】为什么同一个实验得出了两种结论呢?同学们带着这个疑问查阅了相关资料,明白了铝丝在稀盐酸中短时间内无气泡,是因为铝表面致密的氧化膜会先与盐酸反应。
【反思评价】做金属性质实验时需将金属进行打磨,打磨的目的是__________________________,
铁与盐酸反应的方程式是_________________________________________________。
【实验验证】为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、 打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中:
操作 |
|
| 根据现象得出金属活动性顺序 |
现象 | 无明显现象 | ______________________ | Al>Fe>Cu |
写出铁与硫酸铜溶液反应的化学方程式______________________________________________。
【拓展迁移】若只有一支盛有少量稀盐酸的试管,只需合理安排金属丝的插入顺序(能与盐酸反应的要一次将盐酸消耗完),也能证明铁、铝、铜这三种金属的活动性顺序。金属丝的插入顺序为________________________________________________。
【题目】请你结合下列装置图回答问题:
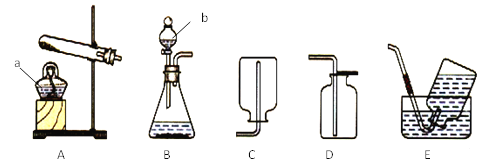
(1)填写下列表格:
制取气体 | 制取该气体的装置(填装置编号) | 收集该气体的装置(填装置编号) |
O2 | _____________ | _____________ |
CO2 | _____________ | _____________ |
(2)写出有标号仪器的名称: b____________,其作用是_________________。选用B装置制备气体,对反应物和反应条件的要求是________________。
(3)实验室用高锰酸钾制氧气的文字表达式:________________________,若用排水法收集氧气,实验结束时应先_____________________,然后________________。反应结束后冷却,对制取氧气后的固体残渣 (假定已完全反应)作如下回收处理:
①通过以下四步实验操作回收二氧化锰。正确操作的先后顺序是_______________(填写序号)。
A.烘干 B.溶解 C.过滤 D.洗涤
②过滤、蒸发时都需用到的仪器是______________(填序号)。
A.酒精灯 B.烧杯 C.玻璃棒 D.漏斗
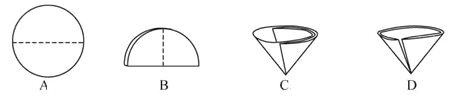
(4)在过滤操作中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是_______(填序号)。
(5)检查B装置气密性的操作方法为:_____________________。