题目内容
将50gCaCl2溶液与77gNa2CO3溶液混合后,恰好完全反应,过滤、洗涤、烘干后,得到10g白色固体。请计算:
(1)CaCl2溶液中溶质的质量为 g。
(2)过滤后所得溶液中溶质的质量分数。(写出计算过程)
(1)11.1(1分
(2)解:设过滤后所得溶液中溶质的质量为x
Na2CO3+ CaCl2= CaCO3↓+2NaCl (1分)
![]() 100 117
100 117
10g x (1分)
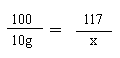
![]() (1分)
(1分)
x=11.7g (1分)
11.7g/(50g+77g—10g)×100%=10% (1分)
答:过滤后所得溶液中溶质的质量分数为10%。

练习册系列答案
相关题目