题目内容
(2012?本溪)将50gCaCl2溶液与77gNa2CO3溶液混合后,恰好完全反应,过滤、洗涤、烘干后,得到10g白色固体.请计算:
(1)CaCl2溶液中溶质的质量为
(2)过滤后所得溶液中溶质的质量分数.(写出计算过程)
(1)CaCl2溶液中溶质的质量为
11.1
11.1
g.(2)过滤后所得溶液中溶质的质量分数.(写出计算过程)
分析:根据溶质质量分数公式以及氯化钙和碳酸钠反应的化学方程式进行计算即可.
解答:解:设生成10g碳酸钙需要氯化钙的质量为x,生成氯化钠的质量为y
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100 117
x 10g y
(1)
=
x=11.1g
(2)过滤后所得溶液中溶质的质量分数为:
×100%=10%
答:(1)CaCl2溶液中溶质的质量为11.1g;
(2)过滤后所得溶液中溶质的质量分数为10%.
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100 117
x 10g y
(1)
| 111 |
| x |
| 100 |
| 10g |
x=11.1g
(2)过滤后所得溶液中溶质的质量分数为:
| 11.7g |
| 50g+77g-10g |
答:(1)CaCl2溶液中溶质的质量为11.1g;
(2)过滤后所得溶液中溶质的质量分数为10%.
点评:本题考查了根据化学方程式的计算,完成此题,可以依据题干提供的数据结合反应的化学方程式进行.

练习册系列答案
相关题目
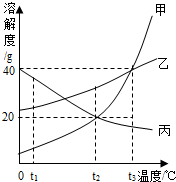 (2012?本溪)甲、乙、丙三种固体物质的溶解度曲线如图所示,根据图示回答下列问题:
(2012?本溪)甲、乙、丙三种固体物质的溶解度曲线如图所示,根据图示回答下列问题: (2012?本溪)小强在用稀盐酸和氢氧化钠溶液进行中和反应实验时,根据实验数据绘制了如图图示.请你根据图示判断:
(2012?本溪)小强在用稀盐酸和氢氧化钠溶液进行中和反应实验时,根据实验数据绘制了如图图示.请你根据图示判断: