题目内容
【题目】向一定质量的AgNO3和Fe(NO3)2的混合溶液中加入X克Zn粉,充分反应后过滤,将滤渣洗涤、干燥后称量,得到的固体质量仍为X克。下列说法错误的是( )
A. 滤液中可能有![]() B. 滤液中一定无
B. 滤液中一定无![]()
C. 滤渣中至少有两种物质D. 滤渣中滴加稀盐酸,可能没有气泡产生
【答案】D
【解析】
锌和硝酸银、硝酸亚铁反应的化学方程式及其质量关系为:
Zn+2AgNO3=Zn(NO3)2+2Ag, Zn+Fe(NO3)2=Zn(NO3)2+Fe,
65 216 65 56
由以上数据可知,锌和硝酸银反应后固体质量增大,和硝酸亚铁反应后固体质量减小,充分反应后过滤,将滤渣洗涤、干燥后称量,得到的固体质量仍为Xg,说明锌和硝酸银、硝酸亚铁都发生了反应,并且硝酸银已经完全反应;
A、滤液有两种可能的组成,即可能是含有硝酸锌和硝酸亚铁两种溶质,因此可能含有硝酸亚铁溶质,该选项说法正确;
B、因为硝酸银已经完全反应,滤液中一定没有硝酸银,该选项说法正确;
C、滤渣中至少有两种物质,即至少含有银和铁,该选项说法正确;
D、滤渣中含有铁,滴加稀盐酸时,铁和稀盐酸反应生成氯化亚铁和氢气,因此一定有气泡产生,该选项说法错误。
故选:D。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
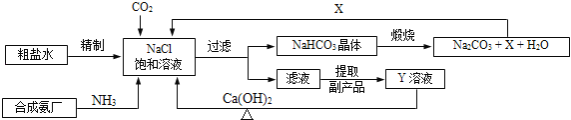
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】我国制碱工业的先驱侯德榜将制碱与制氨结合起来的联合制碱法,为纯碱和氮肥工业技术的发展做出了杰出的贡献.其生产工艺流程示意图如下:
部分物质溶解性(室温) | |||
OH﹣ | SO42﹣ | CO32﹣ | |
Mg2+ | 不 | 溶 | 微 |
Ca2+ | 微 | 微 | 不 |
Ba2+ | 溶 | 不 | 不 |
(1)粗盐水中主要含有Ca2+、Mg2+、SO42﹣等杂质离子,工业上常用加入稍过量的NaOH溶液、Na2CO3溶液、BaCl2溶液及适量的盐酸等除杂、精制.则加入试剂合理的顺序为 、盐酸(只写一种).加盐酸的作用是(用化学方程式表示) 、 。
(2)制碱原理为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,该反应原理可看作是由:①CO2+NH3+H2O=NH4HCO3和
②NaCl+NH4HCO3=NaHCO3↓+NH4Cl两个反应加合而成,则的反应类型为 .
(3)X的化学式为 .
(4)Y是滤液中最主要成分,Y与Ca(OH)2反应的产物之一可用于循环使用,该产物的名称为 ,Y的化学式为 ,写出Y的一种用途 。