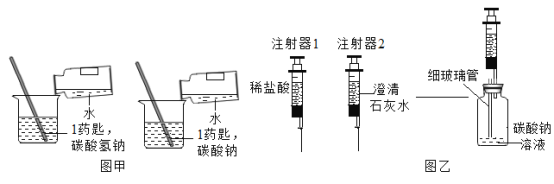
题目内容
【题目】图中A~F是初中化学常见的物质,通常情况下B、E是无色气体,F是红色固体,A在工业上可用来制造玻璃。图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。
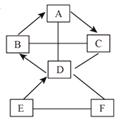
(1)写出化学式:B______,E______。
(2)写出A→C反应的化学方程式______。
(3)写出D与F反应的化学方程式______。
【答案】CO2 H2SO4 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
【解析】
根据图中A~F是初中化学常见的物质,通常情况下B、E是无色气体,F是红色固体,A在工业上可用来制造玻璃,所以A是碳酸钠,B会转化成碳酸钠,所以B是二氧化碳,A转化成的C会与二氧化碳反应,所以C是氢氧化钠,D会与氢氧化钠反应,会转化成二氧化碳,所以D是盐酸,E会转化成盐酸,会与红色固体反应,所以F是氧化铁,E是硫酸,然后将推出的物质进行验证即可。
(1)由推导可知,B是CO2,E是H2SO4;
(2)A→C的反应是碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(3)D与F的反应是氧化铁和硫酸反应生成硫酸铁和水,化学方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O。
故答案为(1)CO2,H2SO4;
(2)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(3)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O。

【题目】对比、归纳是化学学习的重要方法,请补充完成下列实验报告。
(实验目的)探究物理变化和化学变化
(实验过程)
实验操作 | 实验现象、分析或结论 | |
实验一 | 步骤一:取少量硫酸铜晶体放在研钵内观察。 | 现象:晶体为蓝色。 |
步骤二:用研杵将硫酸铜晶体研碎。 | 现象:__________。 | |
步骤三:在2支试管中分别放入少量研碎前、后的硫酸铜晶体,并加入少量水,振荡得到澄清的硫酸铜溶液。 | 现象:研碎后的硫酸铜晶体溶解的更快。 原因是__________。 | |
步骤四:向上述两支试管中各滴加少量氢氧化钠溶液。 | 现象:2支试管中均有蓝色不溶物生成。 该对比实验得出的实验结论是______。 | |
实验二 |
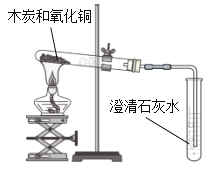
| 现象:有部分黑色粉末变红,澄清石灰水变浑浊。 (1)粉末由黑色变成红色的过程中发生化学反应的化学方程式是__________; (2)上述现象说明木炭和氧化铜发生了化学变化。 |
(实验结论)有其他物质生成的变化叫化学变化,没有其他物质生成的变化叫做物理变化。
【题目】氨气是无色、密度比空气小、极易溶于水![]() 的刺激性气体,强烈刺激眼睛和黏膜。可用于制造化肥、制冷剂,亦可用于炸药、染料、塑料和一些药物的生产等。请回答下列问题:
的刺激性气体,强烈刺激眼睛和黏膜。可用于制造化肥、制冷剂,亦可用于炸药、染料、塑料和一些药物的生产等。请回答下列问题:
(一)氨气的合成是人类科学技术的重大突破,工业上合成氨的微观示意图如下。
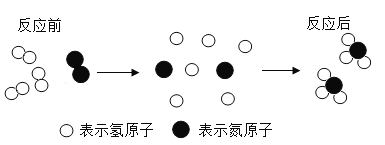
(1)该化学变化过程中不可再分的微粒符号为____________________________。
(2)该反应条件是高温、高压及催化剂,则化学方程式为_________________。
(二)在实验室里,我们可选用下图中所提供的实验装置制取氨气并进行相关实验探究。
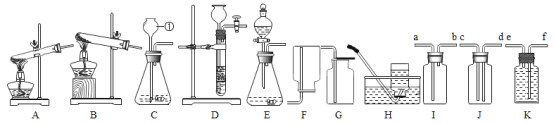
(3)写出标号仪器①的名称___________________________________.
(4)实验室制备氨气是利用氯化铵和熟石灰固体加热来生成,发生反应的化学方程式为____________,选用的装置代码为____________________.其验满的方法是_____________________________________.
(三)天天兴趣小组的同学决定通过实验设计定量研究氨气中氮、氢两种元素的质量比。
(查阅资料)
I.![]()
II. ![]() ;
;![]()
III.干燥剂种类:氯化钙、浓硫酸、氢氧化钠、碱石灰、无水硫酸铜等
(方案设计)天天小组同学将产生氨气装置依据设计流程连接成实验探究装置如下图所示。
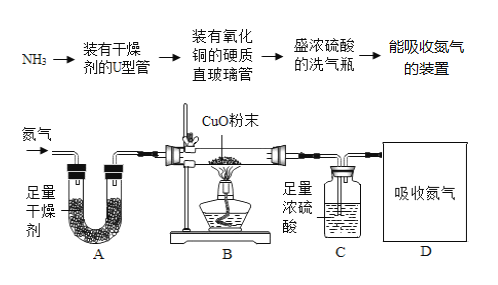
(实验观察)
(5)可作A中U形管内干燥剂的物质是________________________________.
(6)在B装置直玻璃管内出现的现象是____________________________________.
(7)通常把金属氧化物失去氧转化为金属的过程,称为金属氧化物的还原。那么B装置中玻璃管内发生后的还原过程是指_______________________________________________.
(数据分析)待充分反应后,测得A、B、C、D四个装置前后的质量变化如下表所示:
装置编号 | A | B | C | D |
记录数据 | 增加0.1g | 减少4.8g | 增加6.0g | 增加2.8g |
(8)可选择与计算需要数据相应的装置编号为________________________.
(9)通过计算:氮元素质量______________,氢元素质量__________________.列比例式计算氮、氢元素的质量比为____________________________.