题目内容
鸡蛋壳的主要成分是碳酸钙,为了测定蛋壳中碳酸钙的质量分数,小刚和小勇同学进行了如下实验.请回答相关问题:(1)实验过程和测定的相关实验数据如下所示:

小刚根据“蛋壳残渣质量为4.3g”,求得蛋壳中碳酸钙的质量分数为______;
小勇根据“反应过程中减少的质量”,也求得了蛋壳中碳酸钙的质量分数并计算出了盐酸的溶质质量分数,请你写出小勇的计算过程和结果.
(2)小刚和小勇根据不同的数据求得蛋壳中碳酸钙的质量分数有明显差别,请你分析其中可能的原因.
【答案】分析:(1)根据鸡蛋壳的主要成分是碳酸钙,与酸反应后蛋壳残渣质量为4.3g,因碳酸钙能与酸反应,则可计算碳酸钙的质量,再计算蛋壳中碳酸钙的质量分数;
也可利用质量守恒定律,利用反应前后混合物的质量差来计算气体二氧化碳的质量,利用化学反应方程式来计算碳酸钙的质量,进一步计算蛋壳中碳酸钙的质量分数.
(2)根据实验中固体质量的称量及气体的收集等方面来分析其差别.
解答:解:(1)因碳酸钙与酸反应,则残渣质量为4.3g,碳酸钙的质量为10g-4.3g=5.7g,
则蛋壳中碳酸钙的质量分数为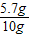 ×100%=57%,故答案为:57%;
×100%=57%,故答案为:57%;
而小勇的计算过程如下:
设碳酸钙的质量为x,氯化氢的质量为y,
根据质量守恒可知CO2的质量10g+100g-106.7g=3.3g,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
x y 3.3g
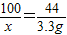 ,
, ,
,
解得x=7.5g,y=5.5g,
则碳酸钙的质量分数为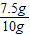 ×100%=75%,
×100%=75%,
盐酸的溶质质量分数为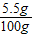 ×100%=5.5%,
×100%=5.5%,
答:蛋壳中碳酸钙的质量分数为75%,盐酸的溶质质量分数为5.5%;
(2)小刚计算所用的蛋壳残渣可能未干燥,实际蛋壳残渣质量小于4.3g
或小勇计算所用的数据“3.3g”中包含了反应过程中盐酸挥发了的氯化氢气体的质量,
即实际生成的二氧化碳气体质量小于3.3g,
答:小刚和小勇根据不同的数据求得蛋壳中碳酸钙的质量分数有明显差别的原因可能为残渣质量未干燥就称量或气体不纯而造成的.
点评:本题考查学生利用化学反应方程式的计算,明确反应后残渣的质量及利用质量守恒来计算二氧化碳的质量是解答的关键.
也可利用质量守恒定律,利用反应前后混合物的质量差来计算气体二氧化碳的质量,利用化学反应方程式来计算碳酸钙的质量,进一步计算蛋壳中碳酸钙的质量分数.
(2)根据实验中固体质量的称量及气体的收集等方面来分析其差别.
解答:解:(1)因碳酸钙与酸反应,则残渣质量为4.3g,碳酸钙的质量为10g-4.3g=5.7g,
则蛋壳中碳酸钙的质量分数为
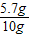 ×100%=57%,故答案为:57%;
×100%=57%,故答案为:57%;而小勇的计算过程如下:
设碳酸钙的质量为x,氯化氢的质量为y,
根据质量守恒可知CO2的质量10g+100g-106.7g=3.3g,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
x y 3.3g
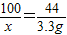 ,
, ,
,解得x=7.5g,y=5.5g,
则碳酸钙的质量分数为
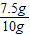 ×100%=75%,
×100%=75%,盐酸的溶质质量分数为
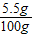 ×100%=5.5%,
×100%=5.5%,答:蛋壳中碳酸钙的质量分数为75%,盐酸的溶质质量分数为5.5%;
(2)小刚计算所用的蛋壳残渣可能未干燥,实际蛋壳残渣质量小于4.3g
或小勇计算所用的数据“3.3g”中包含了反应过程中盐酸挥发了的氯化氢气体的质量,
即实际生成的二氧化碳气体质量小于3.3g,
答:小刚和小勇根据不同的数据求得蛋壳中碳酸钙的质量分数有明显差别的原因可能为残渣质量未干燥就称量或气体不纯而造成的.
点评:本题考查学生利用化学反应方程式的计算,明确反应后残渣的质量及利用质量守恒来计算二氧化碳的质量是解答的关键.

练习册系列答案
相关题目