题目内容
【题目】小明在课外阅读中得知:氢氧化铜受热会分解生成氧化铜,反应的化学方程式为Cu(OH)2 ![]() CuO +H2O,于是用CuSO4溶液与NaOH溶液反应制取氢氧化铜,然后对氢氧化铜进行加热,并用如图所示的装置用一氧化碳还原氢氧化铜完全分解得到的氧化铜。
CuO +H2O,于是用CuSO4溶液与NaOH溶液反应制取氢氧化铜,然后对氢氧化铜进行加热,并用如图所示的装置用一氧化碳还原氢氧化铜完全分解得到的氧化铜。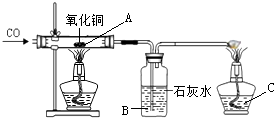
(1)制取氢氧化铜的化学方程式为;
(2)B处可观察到的现象是 , C处酒精灯的作用是 , 小明在做一氧化碳还原氧化铜实验时,硬质玻璃管内发生了爆炸,你认为可能的原因有、;
(3)实验结束后,该同学对A处残留的红色固体的成分进行如下探究:
【查阅资料】①由于给氧化铜加热温度不够或通入一氧化碳不足,可能生成中间产物氧化亚铜(化学式Cu2O)。
②氧化亚铜是一种红色固体,难溶于水,可与稀硫酸发生如下反应:Cu2O+H2SO4=CuSO4+Cu+H2O
【提出猜想】红色固体是:I;ⅡCu2O;ⅢCu和Cu2O的混合物
(4)【进行实验】
操作 | 现象 | 结论 |
①取一定量A处残留固体于试管中,加入足量的稀硫酸,并充分振荡,静置 | 猜想Ⅲ成立 | |
②过滤、洗涤、干燥 | 得到红色固体 |
(5)经测定1.6gA处残留固体与9.8g溶质质量分数为10%的稀盐酸恰好完全反应.试计算该残留固体中铜元素的质量分数。
【答案】
(1)CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
(2)石灰水变浑浊,处理尾气,CO不纯,先加热后通CO
(3)Cu
(4)固体部分溶解,溶液变为蓝色
(5)解:设原固体中Cu2O的质量为X 9.8g×10%=0.98g
Cu2O+ | H2SO4=CuSO4+Cu+H2O |
144 | 98 |
x | 0.98g |
144:98=X:0.98g X=1.44g 1.44g×128/144=1.28g 1.28g+(1.6g—1.44g) =1.44g 1.44g ÷1.6g ×100%= 90%
【解析】(1)氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,化学方程式为CuSO4+2NaOH=Na2SO4+Cu(OH)2↓ ;(2)一氧化碳和氧化铜反应生成二氧化碳和铜;二氧化碳和氢氧化钙反应生成碳酸钙和水,B处可观察到的现象是澄清石灰水变浑浊;C处酒精灯的作用是点燃尾气中的一氧化碳,防止污染空气;点燃可燃性气体和氧气或空气的混合物时,有可能发生爆炸;做一氧化碳还原氧化铜实验时,硬质玻璃管内发生了爆炸,可能的原因有CO不纯 、先加热后通CO ,导致加热了一氧化碳和空气的混合物。(5)由题中信息可知,反应物氧化亚铜和铜都是红色固体,当刚好完全反应时固体为生成物铜;由于Cu2O+H2SO4=CuSO4+Cu+H2O,但是铜不与酸反应,所以会观察到溶液变蓝,固体部分溶解。解设原固体中Cu2O的质量为X 9.8g×10%=0.98g
Cu2O+ | H2SO4=CuSO4+Cu+H2O |
144 | 98 |
x | 0.98g |
144:98=X:0.98g X=1.44g
1.44g×128/144=1.28g 1.28g+(1.6g-1.44g) =1.44g 1.44g ÷1.6g ×100%= 90%
有关生成物成分的探究,在进行猜测时,首先要利用质量守恒定律元素种类不变先推测出相关物质,再利用题中所给定的信息否定不合理的猜想,最后利用化学实验进行猜想的验证;有关方程式的计算,要先写出反应方程式,再找出反应中参加反应或生成的纯净物的质量,根据该物质与其他物质的质量关系列比例式解答。
【考点精析】本题主要考查了一氧化碳的性质和书写化学方程式、文字表达式、电离方程式的相关知识点,需要掌握一氧化碳的物理性质:无色,无味的气体,密度比空气略小,难溶于水;一氧化碳的化学性质:可燃性和还原性;注意:a、配平 b、条件 c、箭号才能正确解答此题.