题目内容
(1)提出假设 ①该反应的气体产物是CO2.②该反应的气体产物是CO.③该反应的气体产物是
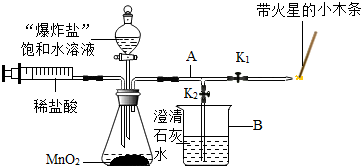
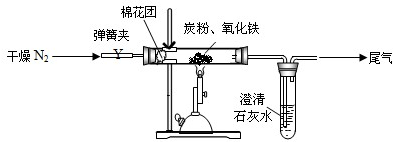
(2)设计方案 如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.
(3)查阅资料 氮气不与碳、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气,同时生成食盐和一种常见液体.请写出该反应的化学方程式:
(4)实验步骤 ①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;②加热前,先通一段时间纯净干燥的氮气;③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;④待反应结束,再缓缓通入一段时间的氮气.冷却至室温,称得硬质玻璃管和固体总质量为52.4g;⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g.步骤②、④中都分别通入N2,其作用分别为
(5)数据处理 试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:
(6)实验优化 学习小组有同学认为应对实验装置进一步完善.
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是
②从环境保护的角度,请你再提出一个优化方案:
(3)根据反应物、生成物及其质量守恒定律可以书写化学方程式;
(4)空气中含有二氧化碳;
(5)根据实验数据分析可知,该实验中氧化铁与碳发生反应生成了铁、一氧化碳和二氧化碳;
(6)氢氧化钡比氢氧化钙更易溶于水,尾气扩散到空气中会污染环境.
故填:CO2、CO.
(3)氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应时,能生成氮气、氯化钠和水,化学方程式为:NaNO2+NH4Cl
| ||
故填:NaNO2+NH4Cl
| ||
(4)步骤②、④中都分别通入N2,其作用分别为:排尽装置中的空气,使生成的二氧化碳全部被石灰水吸收.
故填:排尽装置中的空气;使生成的二氧化碳全部被石灰水吸收.
(5)生成气体的质量为:3.20g+2.00g+48.48g-52.4g=1.28g,
设二氧化碳的质量为X,
Ca(OH)2+CO2=CaCO3↓+H2O,
44 100
X 2.00g
| 44 |
| 100 |
| X |
| 2.00g |
X=0.88g,
生成气体的质量与二氧化碳的质量之差就是生成的一氧化碳的质量,一氧化碳的质量为:1.28g-0.88g=0.4g;
根据实验数据分析,该实验中氧化铁与碳发生反应生成铁、一氧化碳和二氧化碳,反应的化学方程式为:Fe2O3+2C
| ||
故填:Fe2O3+2C
| ||
(6)①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是氢氧化钡易溶于水,可以吸收更多的二氧化碳.
故填:氢氧化钡易溶于水,可以吸收更多的二氧化碳.
②从环境保护的角度,应该对尾气进行处理,方法是点燃或收集尾气.
故填:点燃或收集尾气.

下表是某城市某日空气质量报告:
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | S02 | Ⅱ | 良 |
某研究性学习小组对表中首要污染物S0:导致酸雨的成因进行探究。
(提示:S02:是一种无色、有刺激性气味的有毒气体,易溶于水,具有与C0:相似的化学性质)
【探究实验】实验一:用下图所示装置进行实验。
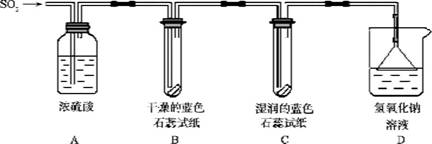
(1)A装置的作用是__________ S02气体。
(2)实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试
纸变红色,说明S02与水反应生成一种 _________________。
(3)D装置的作用是__________,发生反应的化学方程式是 ______________。
实验二:往盛有水的烧杯中通人S02气体,测所得溶液的pH ______ 7(填“>”“=”
或“<”),然后每隔l小时测定其pH,发现pH逐渐变小,直至恒定,说明烧杯中溶液被空
气中的氧气氧化最终生成H2S04。
【查阅资料】S02形成酸雨的另一途径:S02与空气中的02在飘尘的作用下反应生成S03
(飘尘的质量和性质在反应前后不发生变化),S03溶于降水生成H2S04。在此过程中飘尘作______________ 。
【探究结论】S02与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
【模拟实验】(1)由于食醋和酸雨的酸度(pH)差不多,因此酸雨对大理石的作用可以通
过大理石碎片放在醋中来模拟。当把2.0 g大理石碎片放在醋中一整夜后,取出固体干燥
称重,其质量可能是(醋酸钙易溶于水) __________。
A.小于2.0 g B.正好2.0 g C.大于2.0 g
(2)这组学生还做了另一个实验,即将大理石碎片放在蒸馏水中过夜,其实验的目的是
_____________
【知识联想】S02具有与C0:相似的化学性质,根据右图给出
的S02及其化合物问的相互转化关系回答:X的化学式是_____,写出X与Na2S03反应的化学方程________________________________,反应类型是_________________________。