题目内容
某晶体的相对分子质量为126,它可用HXCYOZ?nH2O化学式表示.取6.3g该晶体,在100℃完全失去水后称得固体质量为4.5g.又测得在无水HXCYOZ中H、C、O的质量分数分别为2.2%、26,7%、71.1%,求该晶体的化学式.
考点:有关化学式的计算和推断,化合物中某元素的质量计算
专题:化学式的计算
分析:根据HxCyOz的质量和水的质量并利用相对分子质量来确定n,再根据元素的质量百分比来计算C、H、O原子个数比,从而得出晶体的化学式;
解答:解:由6.3克该晶体,在100℃完全失水后称得固体质量为4.5克,
则水的质量为6.3g-4.5g=1.8g,由晶体分子式可用HxCyOz?nH2O表示,
=
;解得n=2,
由H、C、O在无水HxCyOz的质量百分比分别为2.2%、26.7%、71.1%,
则x:y:z=
:
:
=1:1:2,
再设HxCyOz中H、C、O的原子个数分别为m、m、2m,
则1×m+12×m+16×2m=126-18×2,
解得m=2,
即晶体的化学式为H2C2O4?2H2O,答:晶体的分子式为:H2C2O4?2H2O;
则水的质量为6.3g-4.5g=1.8g,由晶体分子式可用HxCyOz?nH2O表示,
| 6.3 |
| 126 |
| 1.8g |
| 18×n |
由H、C、O在无水HxCyOz的质量百分比分别为2.2%、26.7%、71.1%,
则x:y:z=
| 2.2% |
| 1 |
| 26.7% |
| 12 |
| 71.1% |
| 16 |
再设HxCyOz中H、C、O的原子个数分别为m、m、2m,
则1×m+12×m+16×2m=126-18×2,
解得m=2,
即晶体的化学式为H2C2O4?2H2O,答:晶体的分子式为:H2C2O4?2H2O;
点评:本题较难,确定晶体的化学式是解答的关键,学生应能根据质量和相对原子质量来计算原子个数,注重定组成的分析和应用来解答即可.

练习册系列答案
相关题目
 A-F和X都是初中化学中的常见物质,其中A、C是无色气体,B、F是红色固体,它们的转化关系如下图所示(部分生成物已省略):
A-F和X都是初中化学中的常见物质,其中A、C是无色气体,B、F是红色固体,它们的转化关系如下图所示(部分生成物已省略): 为粗略测量空气中O2与N2的体积比,某学生设计了如图所示的实验装置进行实验.实验时,先关闭弹簧夹a,将螺旋状的铜丝在酒精灯上灼烧后迅速插入大试管,接触试管底部过量的白磷(化学式:P)引燃白磷,然后立即塞紧橡皮塞.可观察到大试管中产生大量的白烟.试回答以下问题:
为粗略测量空气中O2与N2的体积比,某学生设计了如图所示的实验装置进行实验.实验时,先关闭弹簧夹a,将螺旋状的铜丝在酒精灯上灼烧后迅速插入大试管,接触试管底部过量的白磷(化学式:P)引燃白磷,然后立即塞紧橡皮塞.可观察到大试管中产生大量的白烟.试回答以下问题:
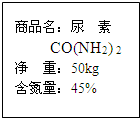 合作学习小组的同学看了尿素产品包装袋上的说明(如图),提出以下问题:
合作学习小组的同学看了尿素产品包装袋上的说明(如图),提出以下问题: