题目内容
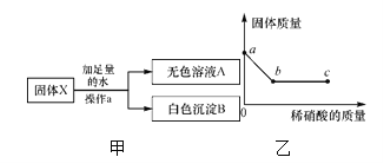
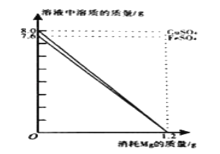
【题目】称取氯化钠和氯化钡的固体混合物32.5克,加入82.8克蒸馏水,完全溶解后向该混合溶液中逐滴加入质量分数为10%的硫酸钠溶液,反应生成沉淀的质量与所加入的硫酸钠溶液的质量关系如图所示。试回答下列问题:
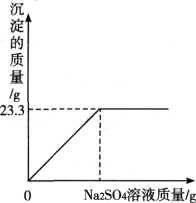
(1)完全反应后生成沉淀________克。
(2)恰好完全反应时消耗硫酸钠溶液的质量是多少克______?
(3)恰好完全反应时所得溶液中溶质的质量分数是多少______?
【答案】23.3 142g 10%
【解析】
(1)从图中可明显看出生成23.3g沉淀后质量不再增加,故完全反应后生成BaSO4沉淀的质量为23.3g;
(2)设BaCl2的质量为x,反应生成的NaCl的质量为y;恰好完全反应时消耗Na2SO4的质量为z:
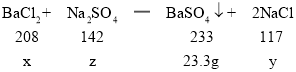
![]()
x=20.8g,y=11.7g,z=14.2g
恰好完全反应时消耗Na2SO4溶液的质量为:14.2g÷10%=142g;
(3)恰好完全反应时,溶液中NaCl的质量为:11.7g+(32.5g-20.8g)=23.4g
恰好完全反应时所得NaCl 溶液溶质的质量分数![]()

【题目】小峰和小刚阅读试剂标签后发现,市场销售的高锰酸钾晶体纯度高达99.5%,含水量可以忽略不计。为探究“试管放置方式对高锰酸钾制取氧气速度和体积的影响”,他俩设计了制取氧气的直立型装置(如图),并与斜卧型装置比较,在气密性良好的装置中分别加入5.0克高锰酸钾晶体,用同一酒精灯分别加热,用同一型号的集气瓶收集气体,每组实验进行五次,实验数据取平均值后记录如下表:
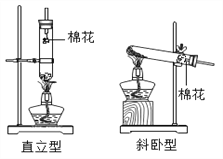
装置类型 | 直立型 | 斜卧型 |
收集1瓶氧气所需时间/秒 | 59 | 68 |
收集2瓶氧气所需时间/秒 | 95 | 108 |
收集氧气的总体积/毫升 | 525 | 476 |
(1)写出高锰酸钾受热分解的化学方程式 ____________________;
(2)收集2瓶氧气,所需时间较短的装置类型是 ____________________;
(3)等质量的高锰酸钾加热到不再产生气体,斜卧型装置收集到氧气的总体积比直立型少的原因是 ____________________ ;
(4)根据高锰酸钾分解的化学方程式,算出5.0克高锰酸钾生成的氧气体积为理论值。实验中发现,斜卧型发生装置收集到的氧气体积明显大于理论值,他们对其原因进行了探究:
【提出假设】
小峰假设:反应生成的二氧化锰在较高温度下受热分解放出氧气;
你的假设:_________________________。
【设计实验】要验证小峰的假设能否成立,请设计简明的实验方案 _______________ 。