题目内容
【题目】(10分)某研究性学习小组的同学用电解水的方法测定水的组成后,提出问题:“测定水的组成还有其他的方法吗?”经过讨论后,得到了肯定的答案,邀请你一起对此展开探究。
【设计方案】甲同学利用氢气还原氧化铜的原理和下图装置及药品进行实验(操作规范)。装置A中发生反应的化学方程式为 ① ,洗气瓶B中浓硫酸的作用为 ②
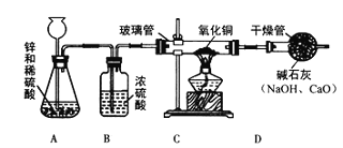
【实验探究】当玻璃管中固体由黑色转变为红色时,实验测得:①装置C的玻璃管和其中固体的总质量在反应后减少了1.6g;②装置D的干燥管和其中物质的总质量在反应后增加了1.82g,用此数据算得水中H、O元素的质量比为 ① ,而由水的化学式算得H、O元素的质量比为 ② 。
【分析交流1】针对上述结果与理论值有偏差,乙同学认为:该装置存在缺陷,此观点得到了大家的认同,你对此改进的方法是________________。
(假设生成的水完全被D中碱石灰吸收,装置内空气中的水蒸气、CO2忽略不计)。小组同学用改进后的装置重新实验得到了正确结果。
【意外发现】丙同学不小心将反应后的少量红色固体a洒落到多量稀硫酸中了,发现除了有红色固体b以外,溶液的颜色由无色变为蓝色。
【提出问题】铜与稀硫酸是不反应的,这里溶液的颜色为什么会变蓝呢?
【查阅资料】①CuO被还原的过程中会有Cu2O生成,Cu2O也能被还原成Cu;
②Cu2O固体是红色的,它与稀硫酸的反应为:Cu2O+H2SO4=CuSO4+Cu+H2O.
【得出结论】红色固体a中含有Cu2O。
【分析交流2】红色固体a中含 有Cu2O是否会影响水组成的测定结果 (填“影响”或“不影响”)。
【提出猜想】针对红色固体a的成分,小组同学提出猜想①是:Cu2O;
猜想②是:________________。
【拓展探究】丁同学利用改进后的装置及药品重新实验,通过测量反应前后固体质量的方法去确定哪种猜想成立,他已称得:①玻璃管的质量;②反应前红色固体a和玻璃管的总质量,完全反应后,你认为他还需要称量 的质量。
【教师点拨】称取一定质量的红色固体a与足量的稀硫酸充分反应后,经过滤、洗涤、干燥后再称量红色固体b的质量,也可以确定哪种猜想成立。
【定量分析】小组同学再次实验,他们开始称取质量为3.6g的红色固体a,与足量的稀硫酸完全反应后得到红色固体b为2g请通过计算说明,哪个猜想成立。
【答案】【设计方案】 ①Zn + H2SO4 == ZnSO4 + H2↑ ②吸收水蒸气或干燥氢气
【实验探究】 ①1.1:8 、②1:8
【分析交流1】在D装置后,再连接一个盛碱石灰的干燥管,(防止空气中的水蒸气和CO2加入D装置)
【分析交流2】 不影响
【提出猜想】猜想②是:Cu2O和Cu
【拓展探究】他还需要称量反应后红色固体和玻璃管的总质量
【定量分析】猜想②正确
【解析】
试题分析:装置A中发生反应的化学方程式为Zn + H2SO4 == ZnSO4 + H2↑;洗气瓶B中浓硫酸的作用为吸收水蒸气,干燥氢气;装置C的玻璃管和其中固体的总质量在反应后减少了1.6g,说明其中含有的氧元素的质量为1.6克,而装置D的干燥管和其中物质的总质量在反应后增加了1.82g,说明水的质量为1.82克,则其中含有氢元素的质量为0.22克,因此用此数据算得水中H、O元素的质量比为1.1:8;由水的化学式算得H、O元素的质量比为=2:16=1:8;结果与理论值有偏差,乙同学认为:该装置存在缺陷,对此改进的方法是在D装置后,再连接一个盛碱石灰的干燥管,防止空气中的水蒸气和CO2加入D装置;红色固体a中含 有Cu2O不会影响水组成的测定结果,因为其中的氧元素完全转化为水中去,因此红色固体a的成分有两种猜想①是:Cu2O;猜想②是:Cu2O和Cu;通过测量反应前后固体质量的方法去确定哪种猜想成立,除了要称量①玻璃管的质量;②反应前红色固体a和玻璃管的总质量,完全反应后,还需要称量反应后红色固体和玻璃管的总质量;设其中Cu2O的质量为X。
Cu2O+H2SO4=CuSO4+Cu+H2O 固体减少的质量
144 64 80
X 1.6克
列比例式得:144:X=80:1.6克 求得X=2.88克, 说明其中还含有铜,且铜的质量为3.6克-2.88克=0.72克。所以猜想②正确。