题目内容
【题目】同一个化学反应在不同条件下反应的快慢(即反应速率)是不同的。下列三组实验是探究不同条件对金属锌与盐酸反应速率的影响
实验操作 | 现象 | 结论 | |
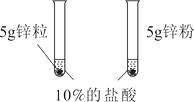
第1组 |
| ①(选填“锌粒”或“锌粉”)反应更加剧烈。 | 反应物表面积越大,反应速率越大。 |
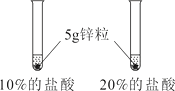
第2组 |
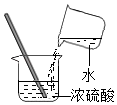
| 锌粒与20%的盐酸反应更加剧烈。 | 反应物② 越大,反应速率越大。 |
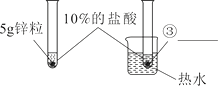
第3组 |
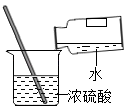
| 置于热水的试管反应更加剧烈。 | 温度越高,反应的速率越大。 |
(1)将表中的空格填写完整①②③
(2)请写出锌与稀盐酸反应的化学方程式
(3)为了提高铁与盐酸反应的反应速率,请提出一种实验方案
(4)综合其它实验结果,相同质量的铁、锌、铜与足量的稀盐酸反应产生氢气的质量关系如下图,其中正确的是(填选项)
A.
B.
C.
D.
【答案】
(1)锌粉,浓度,5g锌粒
(2)Zn+2HCl =ZnCl2+H2↑
(3)使用铁粉(或增大盐酸浓度;或加热等合理答案皆可)
(4)D
【解析】(1)①反应物表面积越大,反应速率越大。锌粉比锌粒与酸接触面积大,所以锌粉反应更加剧烈。②锌粒与20%的盐酸比10%的盐酸反应更加剧烈,反应物浓度越大 ,反应速率越大。③依据控制变量原则,两个试管中,只有温度不同,其它影响反应速率的因素都相同,所以热水中也是5g锌粒。(2)锌与稀盐酸反应生成氯化锌和氢气,化学方程式为Zn+2HCl =ZnCl2+H2↑ ;
(3)由(1)得出的结论可知,为了提高铁与盐酸反应的反应速率,可以使用较高浓度的盐酸,或者使用铁粉、或者使反应在加热条件下进行;
(4)铁、锌、铜与足量的稀盐酸反应产生氢气的质量铁比锌多,铜不反应,不能生成氢气,只有D符合.
所以答案是:(1)锌粉;浓度;5g锌粒;(2)Zn+2HCl=ZnCl2+H2↑;(3)使用铁粉(或增大盐酸浓度;或加热等合理答案皆可);(4)D.
【考点精析】通过灵活运用金属材料的选择依据和书写化学方程式、文字表达式、电离方程式,掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属;注意:a、配平 b、条件 c、箭号即可以解答此题.