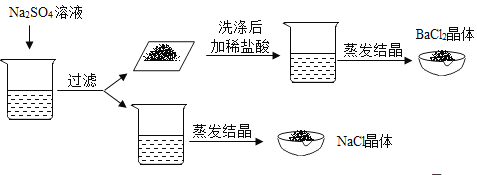
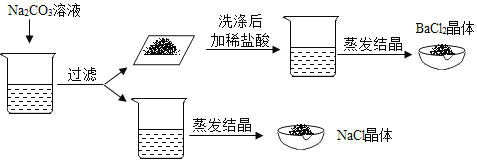
题目内容
【题目】工业烟气脱硫中采用“双碱法”脱硫的工业流程如下:
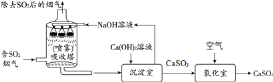
(1)吸收塔中,用NaOH溶液吸收SO2生成亚硫酸钠(Na2SO3)和水,则Na2SO3中硫元素的化合价为______。
(2)沉淀室中发生了复分解反应,请写出此反应的化学方程式_________。
【答案】+4 Na2SO3+ Ca(OH)2==CaSO3![]() +2NaOH
+2NaOH
【解析】
流程图含二氧化硫的氧气通过吸收塔,被氢氧化钠吸收,生成亚硫酸钠和水,亚硫酸钠与氢氧化钙反应生成亚硫酸钙沉淀和氢氧化钠,氢氧化钠继续循环,亚硫酸钙在氧化室中被空气氧化,得到硫酸钙。
(1)Na2SO3中硫元素的化合价为:![]() x=+4;故填:+4
x=+4;故填:+4
(2)沉淀室中氢氧化钙和亚硫酸钠发生了复分解反应,生成了氢氧化钠和亚硫酸钙,化学方程式为:Na2SO3+ Ca(OH)2==CaSO3![]() +2NaOH;故填:Na2SO3+ Ca(OH)2==CaSO3
+2NaOH;故填:Na2SO3+ Ca(OH)2==CaSO3![]() +2NaOH
+2NaOH

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案
相关题目