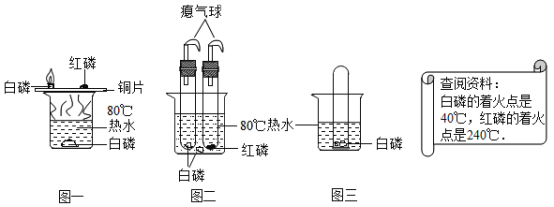
题目内容
【题目】实验探究和证推理是提升认知的重要手段。
某同学将氢氧化钠溶液加入到一定量的稀氯化铜溶液中,出现蓝绿色不溶于水的固体。该同学对生成蓝绿色而不是蓝色体的现象产生疑惑。
(资料)
(1).CuCl2溶液与NaOH溶液反应可生成值色体( Cu(OH)2).在氢氧化钠较少的情况下会生成蓝绿色碱式氯化铜(Cu(OH)Cl).其不溶于水,能与酸反应。
(2)Cu(OH)2在60℃开始分解生成两种氧化物,100℃分解完全,碱式氯化铜在300℃开始分解生成氧化铜、水和氯化氢,在400℃分解完全,
(猜想)蓝绿色固体可能是:①Cu(OH)2②Cu(OH)Cl晶体:③_________________。
猜想①的理由是:________________ (用化学方程式表示)。
(实验)该同学取31.25g蓝绿色固体,加热至100℃出现黑色固体,则猜想______不正确。继续加热到400℃至质量不再改变,并使产生的气体全部缓缓通过如图所示装置(装置中药品足量)
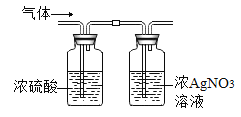
已知实验所得数据
①最终得到剩余固体24.00g;
②与硝酸银溶液反应得到的沉淀经过滤、洗涤和低温烘干,得到固体14.35g
完成下列问题:
(1)判断固体已洗净的方法是:取最后一次洗液,滴加______溶液,无现象
(2)过上述实验数据计算蓝绿色固体中铜元素和氯元素的质量比_________________。
(结论)猜想③成立
(延伸)
(1)碱式氯化铜常作为动物词料的添加剂,则该碱式氯化铜与胃液发生反应的化学方程式为_______________。
(2)如果欲使HCl和CuCl2的混合溶液中的溶质只有CuCl2,可向其中加入过量的___(填序号)
A CuO B Cu(OH)2 C Cu D Cu(NO3)2
(3)为使实验中生成蓝色固体,少出现蓝绿色固体,应作______改进(选填序号)
A 实验中将氯化铜溶液滴加到氢氧化钠溶液中
B 实验中应提供足量、较浓的氢氧化钠溶液
C 实验应该在80℃的水浴中进行
【答案】Cu(OH)2和Cu(OH)Cl晶体的混合物 CuCl2+2NaOH=Cu(OH)2↓+2NaCl ② 稀盐酸 384:71 Cu(OH)Cl+HCl= CuCl2+H2O A B AB
【解析】
[猜想]蓝绿色固体可能是二者的混合物:③ Cu(OH)2和Cu(OH)Cl晶体的混合物;猜想①的理由是氯化铜和氢氧化钠反应生成氢氧化铜和氯化钠。
Cu(OH)2在60℃开始分解生成两种氧化物,100℃分解完全,该同学取31.25g蓝绿色固体,加热至100℃出现黑色固体,则猜想②不正确。
①最终得到剩余固体氧化铜24.00g,
②与硝酸银溶液反应得到的沉淀经过滤、洗涤和低温烘干,得到固体氯化银14.35g
(1)硝酸银和稀盐酸反应生成氯化银沉淀,判断固体已洗净即判定是否有硝酸银。
(2)过上述实验数据计算蓝绿色固体中铜元素质量为24.00g×![]() =19.2g,氯化银中氯元素的质量为14.35g×
=19.2g,氯化银中氯元素的质量为14.35g×![]() =3.55g。
=3.55g。
[延伸]
(1)碱式氯化铜常作为动物词料的添加剂,则该碱式氯化铜与胃液发生反应生成氯化铜和水。
(2)如果欲使HCl和CuCl2的混合溶液中的溶质只有CuCl2,可向其中加入过量的氧化铜和氢氧化铜,多余的氧化铜和氢氧化铜过滤除去;
(3)为使实验中生成蓝色固体,少出现蓝绿色固体,实验中将氯化铜溶液滴加到氢氧化钠溶液,实验中应提供足量、较浓的氢氧化钠溶液。
[猜想]蓝绿色固体可能是:③ Cu(OH)2和Cu(OH)Cl晶体的混合物;
猜想①的理由是氯化铜和氢氧化钠反应生成氢氧化铜和氯化钠,CuCl2+2NaOH=Cu(OH)2↓+2NaCl。
Cu(OH)2在60℃开始分解生成两种氧化物,100℃分解完全,该同学取31.25g蓝绿色固体,加热至100℃出现黑色固体,则猜想②不正确。
①最终得到剩余固体氧化铜24.00g,
②与硝酸银溶液反应得到的沉淀经过滤、洗涤和低温烘干,得到固体氯化银14.35g
(1)硝酸银和稀盐酸反应生成氯化银沉淀,判断固体已洗净的方法是:取最后一次洗液,滴加稀盐酸溶液,无现象。
(2)过上述实验数据计算蓝绿色固体中铜元素质量为24.00g×![]() =19.2g,氯化银中氯元素的质量为14.35g×
=19.2g,氯化银中氯元素的质量为14.35g×![]() =3.55g,铜元素和氯元素的质量比为19.2g:3.55g=384:71。
=3.55g,铜元素和氯元素的质量比为19.2g:3.55g=384:71。
[延伸]
(1)碱式氯化铜常作为动物词料的添加剂,则该碱式氯化铜与胃液发生反应生成氯化铜和水,化学方程式为Cu(OH)Cl+HCl= CuCl2+H2O。
(2)如果欲使HCl和CuCl2的混合溶液中的溶质只有CuCl2,可向其中加入过量的氧化铜和氢氧化铜,多余的氧化铜和氢氧化铜过滤除去;铜和硝酸铜都不能除去盐酸。
故选A B。
(3)为使实验中生成蓝色固体,少出现蓝绿色固体,实验中将氯化铜溶液滴加到氢氧化钠溶液,实验中应提供足量、较浓的氢氧化钠溶液,故选AB。

【题目】实验室模拟工业炼铁的装置图如图所示。

(1)写出一氧化碳与氧化铁反应的化学方程式__________________。
(2)写出硬质玻璃管中的现象__________________。
(3)写出最右侧酒精灯的作用__________________。
【答案】Fe2O3+3CO![]() 2Fe+3CO2 红色粉末逐渐变黑 点燃尾气,防止CO污染空气
2Fe+3CO2 红色粉末逐渐变黑 点燃尾气,防止CO污染空气
【解析】
(1)由题意可知,在高温条件下,一氧化碳能与氧化铁反应,生成了铁和二氧化碳。反应的方程式是:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(2)由于氧化铁是红色的,生成的铁粉是黑色的。所以,硬质玻璃管中的现象是:红色粉末逐渐变黑;
(3)由于尾气中含有的一氧化碳有毒能污染空气。所以,最右侧酒精灯的作用是:点燃尾气,防止CO污染空气。
故答案为:Fe2O3+3CO![]() 2Fe+3CO2;红色粉末逐渐变黑;点燃尾气,防止CO污染空气。
2Fe+3CO2;红色粉末逐渐变黑;点燃尾气,防止CO污染空气。
【题型】实验题
【结束】
25
【题目】酸、碱、盐是几类重要的化合物,他们之间能发生复分解反应。
(1)复分解反应发生的条件是有沉淀析出,或有气体放出,或有____________生成。
(2)某化学小组进行“酸和碱的中和反应”实验:将盐酸滴入一定量的澄清石灰水中,实验无明显现象。取反应后的部分溶液加热、蒸干、得到白色固体。
以下是探究白色固体成分的实验,已知CaCl2溶液呈中性。请填写下表:
实验操作 | 测定结果 | 白色固体成分 |
用pH试纸测定反应后溶液的酸碱度,操作方法是_______ | pH>7 | __________ |
_______ | CaCl2 |
实验反思:无明显现象的中和反应可借助酸碱指示剂判断反应终点。
(3)“粗盐提纯”指除去NaCl中的泥沙和MgCl2、CaCl2、Na2SO4等杂质。某同学设计了除去三种可溶性杂质的实验方案:先将固体溶解,然后向其中依次加入过量的BaCl2、NaOH、Na2CO3溶液,充分反应后过滤,蒸发结晶。请回答:
①溶解、过滤和蒸发操作中都用到一种玻璃仪器是_______?该仪器在蒸发操作中的作用是_______?
②加入Na2CO3溶液的目的是______________?
③以上方案还需完善,请说明原因并加以补充_______。
(4)工业上常用NaOH溶液处理铝土矿(主要成分为Al2O3),反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O(杂质不参与反应也不溶于水)。若用160 kg NaOH配制的溶液恰好能处理340 kg铝土矿,最终得到1 004 kg NaAlO2溶液。计算:该铝土矿中Al2O3的质量分数_______。