题目内容
【题目】现有一包由铁粉、木炭粉、镁粉组成的固体混合物5g,向其中加入一定溶质质量分数的稀盐酸100g,充分反应后过滤,得到滤液103.8g、滤渣1g,下列说法中正确的是( )
A.生成氢气的质量是0.2g
B.滤液中一定含有氯化镁、氯化亚铁和盐酸
C.稀盐酸的溶质质量分数小于或等于7.3%
D.若滤渣的成分是木炭粉,则混合物中铁、镁的质量比为7:3
【答案】AD
【解析】
由题意可得,铁粉、镁粉可以与稀盐酸反应并释放出氢气,木炭粉不与稀盐酸反应.
A、铁粉、镁粉可以与稀盐酸反应并释放出氢气,木炭粉不与稀盐酸反应.生成氢气的质量为:5g+100g﹣103.8g﹣1g=0.2g,该选项说法正确;
B、若铁粉、镁粉恰好与稀盐酸反应,滤液中只含有氯化镁、氯化亚铁,该选项说法不正确;
C、当铁粉、镁粉恰好与稀盐酸反应时,稀盐酸的质量分数最小,设稀盐酸的溶质质量为x,
由铁粉、镁粉与稀盐酸反应方程式 Fe+2HCl=FeCl2+H2↑、Mg+2HCl=MgCl2+H2↑可得关系式
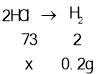
![]()
x=7.3g,
此时稀盐酸的溶质质量分数为:![]() ×100%=7.3%,
×100%=7.3%,
所以,稀盐酸的溶质质量分数大于或等于7.3%,该选项说法不正确;
D、设混合物中铁粉和镁粉的质量分别是m,n,
由铁粉、镁粉与稀盐酸反应方程式
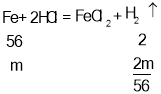
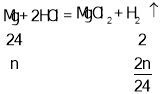
m+n=4g,![]() +
+![]() =0.2g,
=0.2g,
解得m=2.8g,n=1.2g,
则混合物中铁、镁的质量比为:2.8g:1.2g=7:3,该选项说法正确.
故选:AD.

练习册系列答案
相关题目