题目内容
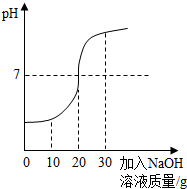 (2012?宁德)化学兴趣小组对某工业废水(含有H2SO4、Na2SO4)中H2SO4的含量进行测定.甲、乙两同学各提出不同的测定方法:
(2012?宁德)化学兴趣小组对某工业废水(含有H2SO4、Na2SO4)中H2SO4的含量进行测定.甲、乙两同学各提出不同的测定方法:(1)甲同学:酸碱中和法取60g废水于烧杯中,逐渐滴入溶质质量分数为10%的NaOH溶液(反应的化学方程式为:H2SO4+2NaOH═Na2SO4+2H2O),反应过程溶液pH变化如右图,求60g废水中H2SO4的质量.
(2)乙同学:沉淀分析法改用BaCl2溶液代替NaOH溶液测定废水中的H2SO4的含量(反应的化学方程式为:H2SO4+BaCl2═BaSO4↓+2HCl),你认为结果会
偏高
偏高
(填“偏高”、“偏低”、“不变”)理由是BaCl2溶液也会与废水中的Na2SO4反应
BaCl2溶液也会与废水中的Na2SO4反应
.分析:(1)硫酸可以和氢氧化钠发生中和反应,它们恰好完全反应时溶液呈中性,分析图象可以知道恰好完全反应时消耗氢氧化钠溶液的质量为20g,可以据此结合反应的化学方程式可以计算出废水中硫酸的质量;
(2)氯化钡溶液可以和硫酸反应生成硫酸钡沉淀,也可以和硫酸钠溶液反应生成硫酸钡沉淀,可以据此进行分析并完成解答.
(2)氯化钡溶液可以和硫酸反应生成硫酸钡沉淀,也可以和硫酸钠溶液反应生成硫酸钡沉淀,可以据此进行分析并完成解答.
解答:解:(1)设废水中硫酸的质量为x
H2SO4+2NaOH═Na2SO4+2H2O
98 80
x 20g×10%=2g
=
解得:x=2.45g
答:废水中硫酸的质量为2.45g
(2)氯化钡溶液可以和硫酸反应生成硫酸钡沉淀,也可以和硫酸钠溶液反应生成硫酸钡沉淀,所以会导致测定结果偏高.
故答案为:(1)2.45g;
(2)偏高;BaCl2溶液也会与废水中的Na2SO4反应.
H2SO4+2NaOH═Na2SO4+2H2O
98 80
x 20g×10%=2g
| 98 |
| x |
| 80 |
| 2g |
解得:x=2.45g
答:废水中硫酸的质量为2.45g
(2)氯化钡溶液可以和硫酸反应生成硫酸钡沉淀,也可以和硫酸钠溶液反应生成硫酸钡沉淀,所以会导致测定结果偏高.
故答案为:(1)2.45g;
(2)偏高;BaCl2溶液也会与废水中的Na2SO4反应.
点评:本题考查了酸的化学性质以及根据化学方程式的计算,完成此题,可以根据已有的酸的性质以及根据化学方程式的有关计算进行.

练习册系列答案
相关题目
 (2012?宁德质检)A、B、C是三种不同类别的物质,都含有一种相同的元素,这三种物质和CaCl2的转化关系如图所示(“→”表示在一定条件下能发生转化).
(2012?宁德质检)A、B、C是三种不同类别的物质,都含有一种相同的元素,这三种物质和CaCl2的转化关系如图所示(“→”表示在一定条件下能发生转化).