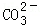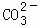题目内容
从海水得到的粗盐,往往含有可溶性杂质(主要有)和不溶性杂质(泥沙等),必须进行分离和提纯后才能用于工业生产和人们的日常生活.粗盐提纯的部分流程如下:
 其中,滤液一至滤液二之间需进行三步操作:
其中,滤液一至滤液二之间需进行三步操作:
操作一: 加入过量的碳酸钠,除去滤液中的Ca2+
操作二: 加入过量的X,除去滤液中的M g2+
g2+
操作三: 加入过量的氯化钡,除去滤液中的SO42-
请回答:
(1)操作中的物质X为 ,正确的操作顺序为  (填序号),为最终获得精盐,操作①、②和③后还需增加的操作是 ;
(填序号),为最终获得精盐,操作①、②和③后还需增加的操作是 ;
(2)滤液二中加入适量稀盐酸的目的是 .
(1)NaOH ③①② 过滤
(2)除去操作中加入的过量NaOH和Na2CO3
说明:(1)中第二空, 其他合理答案也可
如果第一空为Ca(OH)2或Ba(OH)2,第二空为③②①或②③①

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
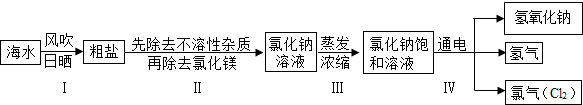
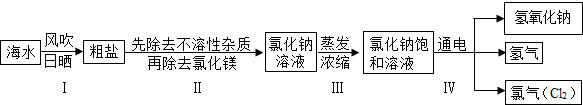
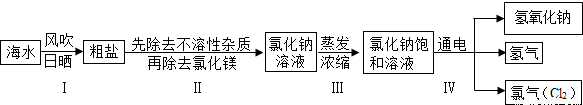
小学同步三练核心密卷系列答案闽东毗邻东海,海洋资源十分丰富.从海水中提取氯化钠并以氯化钠和水为原料制取氢氧化钠、氯气等物质的工艺流程图如下:
某兴趣小组进行如下实验:
【实验一】除去粗盐中的不溶性杂质
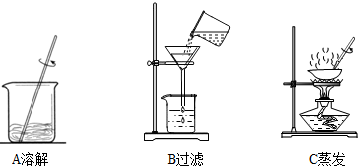
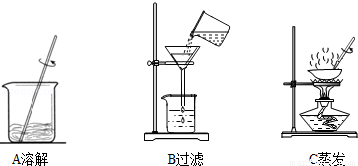
步骤一:用托盘天平称取5.0g粗盐,用药匙将该粗盐逐渐加入盛10mL水的烧杯中,边加边用玻璃棒搅拌,一直加到粗盐不再溶解为止.称量剩下的粗盐质量为1.4g
步骤二:经过过滤、蒸发,得到3.2g精盐.
(1)计算精盐的产率 (保留一位小数).
(2)该小组测得的产率偏低,可能的原因是 .
A.溶解时未充分搅拌
B.蒸发时水分未蒸干
C.蒸发时盐粒溅出蒸发皿
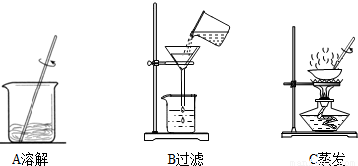
(3)步骤一、二的部分操作如图所示,其中错误的是 (填字母序号).
【实验二】探究工艺流程图步骤Ⅱ所得的氯化钠溶液中MgCl2是否除尽,溶液中是否含有CaCl2
[查阅资料]有关物质的溶解性表(20℃)
|
阴离子 阳离子 |
OH﹣ |
|
|
Ca2+ |
微 |
不 |
|
Mg2+ |
不 |
微 |
[进行实验]请你与他们共同完成,并回答所给的问题:
|
实验步骤 |
实验现象 |
实验结论 |
|
步骤一:取一定量的氯化钠溶液于试管中,加入适量的NaOH溶液 |
无明显现象 |
说明MgCl2 (填“已”或“未”)除尽 |
|
步骤二:往步骤一所得溶液中加入适量的 溶液 |
产生白色沉淀 |
说明溶液中含有CaCl2 |
[拓展思维]
(1)工艺流程图步骤Ⅰ从海水中得到粗盐,采用风吹日晒蒸发溶剂的方法,而不是采用降低溶液温度的方法,原因是 .
(2)写出工艺流程图步骤Ⅳ的化学方程式 .
闽东毗邻东海,海洋资源十分丰富.从海水中提取氯化钠并以氯化钠和水为原料制取氢氧化钠、氯气等物质的工艺流程图如下: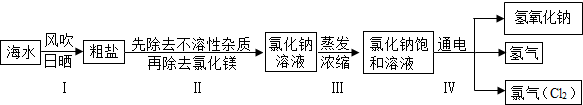
某兴趣小组进行如下实验:
【实验一】除去粗盐中的不溶性杂质
步骤一:用托盘天平称取5.0g粗盐,用药匙将该粗盐逐渐加入盛10mL水的烧杯中,边加边用玻璃棒搅拌,一直加到粗盐不再溶解为止.称量剩下的粗盐质量为1.4g
步骤二:经过过滤、蒸发,得到3.2g精盐.
(1)计算精盐的产率______(保留一位小数).
(2)该小组测得的产率偏低,可能的原因是______.
A.溶解时未充分搅拌
B.蒸发时水分未蒸干
C.蒸发时盐粒溅出蒸发皿
(3)步骤一、二的部分操作如图所示,其中错误的是______(填字母序号).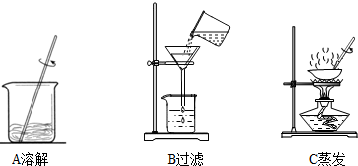
【实验二】探究工艺流程图步骤Ⅱ所得的氯化钠溶液中MgCl2是否除尽,溶液中是否含有CaCl2
[查阅资料]有关物质的溶解性表(20℃)
| 阴离子 阳离子 | OH- | 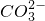 |
| Ca2+ | 微 | 不 |
| Mg2+ | 不 | 微 |
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤一:取一定量的氯化钠溶液于试管中,加入适量的NaOH溶液 | 无明显现象 | 说明MgCl2______(填“已”或“未”)除尽 |
| 步骤二:往步骤一所得溶液中加入适量的______溶液 | 产生白色沉淀 | 说明溶液中含有CaCl2 |
(1)工艺流程图步骤Ⅰ从海水中得到粗盐,采用风吹日晒蒸发溶剂的方法,而不是采用降低溶液温度的方法,原因是______.
(2)写出工艺流程图步骤Ⅳ的化学方程式______.
闽东毗邻东海,海洋资源十分丰富.从海水中提取氯化钠并以氯化钠和水为原料制取氢氧化钠、氯气等物质的工艺流程图如下: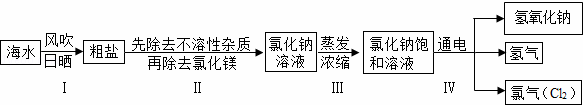
某兴趣小组进行如下实验:
【实验一】除去粗盐中的不溶性杂质
步骤一:用托盘天平称取5.0g粗盐,用药匙将该粗盐逐渐加入盛10mL水的烧杯中,边加边用玻璃棒搅拌,一直加到粗盐 不再溶解为止.称量剩下的粗盐质量为1.4g
不再溶解为止.称量剩下的粗盐质量为1.4g
步骤二:经过过滤、蒸发,得到3.2g精盐.
(1)计算精盐的产率 (保留一位小数).
(2)该小组测得的产率偏低,可能的原因是 .
A.溶解时未充分搅拌
B.蒸发时水分未蒸干
C.蒸发时盐粒溅出蒸发皿
(3)步骤一、二的部分操作如图所示,其中错误的是 (填字母序号).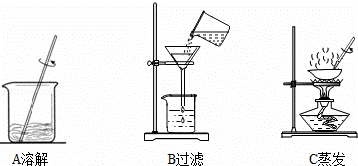
【实验二】探究工艺流程图步骤Ⅱ所得的氯化钠溶液中MgCl2是否除尽,溶液中是否含有CaCl2
[查阅资料]有关物质的溶解性表(20℃)
| 阴离子 阳离子 | OH﹣ |
|
| Ca2+ | 微 | 不 |
| Mg2+ | 不 | 微 |
[进行实验]请你与他们共同完成,并回答所给的问题:
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤一:取一定量的氯化钠溶液于试管中,加入适量的NaOH溶液 | 无明显现象 | 说明MgCl2 (填“已”或“未”)除尽 |
| 步骤二:往步骤一所得溶液中加入适量的 溶液 | 产生白色沉淀 | 说明溶液中含有CaCl2 |
[拓展思维]
(1)工艺流程图步骤Ⅰ从海水中得到粗盐,采用风吹日晒蒸发溶剂的方法,而不是采用降低溶液温度的方法,原因是 .
(2)写出工艺流程图步骤Ⅳ的化学方程式 .
某兴趣小组进行如下实验:
【实验一】除去粗盐中的不溶性杂质
步骤一:用托盘天平称取5.0g粗盐,用药匙将该粗盐逐渐加入盛10mL水的烧杯中,边加边用玻璃棒搅拌,一直加到粗盐不再溶解为止.称量剩下的粗盐质量为1.4g
步骤二:经过过滤、蒸发,得到3.2g精盐.
(1)计算精盐的产率 (保留一位小数).
(2)该小组测得的产率偏低,可能的原因是 .
A.溶解时未充分搅拌
B.蒸发时水分未蒸干
C.蒸发时盐粒溅出蒸发皿
(3)步骤一、二的部分操作如图所示,其中错误的是 (填字母序号).
【实验二】探究工艺流程图步骤Ⅱ所得的氯化钠溶液中MgCl2是否除尽,溶液中是否含有CaCl2
[查阅资料]有关物质的溶解性表(20℃)
| 阴离子 阳离子 | OH- | 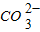 |
| Ca2+ | 微 | 不 |
| Mg2+ | 不 | 微 |
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤一:取一定量的氯化钠溶液于试管中,加入适量的NaOH溶液 | 无明显现象 | 说明MgCl2 (填“已”或“未”)除尽 |
| 步骤二:往步骤一所得溶液中加入适量的 溶液 | 产生白色沉淀 | 说明溶液中含有CaCl2 |
(1)工艺流程图步骤Ⅰ从海水中得到粗盐,采用风吹日晒蒸发溶剂的方法,而不是采用降低溶液温度的方法,原因是 .
(2)写出工艺流程图步骤Ⅳ的化学方程式 .