题目内容
【题目】甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确是( ) 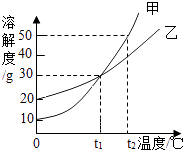
A.甲和乙的饱和溶液,从t1℃升温到t2℃,仍是饱和溶液
B.甲和乙的饱和溶液,从t1℃升温到t2℃,溶液中溶质的质量分数甲>乙
C.t1℃时,甲和乙的溶解度相等
D.t2℃时,在100g水中放入60g甲,形成不饱和溶液
【答案】C
【解析】解:A、甲、乙物质的溶解度随温度的升高而增大,所以甲和乙的饱和溶液,从t1℃升温到t2℃,变成不饱和溶液,故A错误; B、t1℃时,甲、乙物质的溶解度相等,所以甲和乙的饱和溶液,从t1℃升温到t2℃,溶液中溶质的质量分数甲=乙,故B错误;
C、通过分析溶解度曲线可知,t1℃时,甲和乙的溶解度相等,故C正确;
D、t2℃时,甲物质的溶解度是50g,所以在100g水中放入60g甲,形成饱和溶液,故D错误.
故选:C.
【考点精析】认真审题,首先需要了解固体溶解度曲线及其作用(1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和)),还要掌握溶质的质量分数、溶解性和溶解度的关系(溶质质量分数 =溶质质量/溶液质量*100% ;溶解度=溶质质量/溶剂质量*100g (必须选取饱和溶液);溶液质量=溶质质量(克)+溶剂质量(克) ;对于饱和溶液,溶液质量分数w = S/(S+100);所以溶解度S = 100/(1/w-1))的相关知识才是答题的关键.

【题目】为测定某地石灰石样品中碳酸钙的质量分数,进行以下实验;
向装有10.0g石灰石样品的烧杯中,加入47.2g稀盐酸,恰好完全反应,烧杯中剩余物质的总质量随时间变化关系如下表:(石灰石中的杂质不参加反应且难溶于水)
时间/min | t1 | t2 | t3 | t4 | t5 | t6 |
烧杯中剩余物质的总质量/g | 56.7 | 56.2 | 55.7 | 55.2 | 55.0 | 55.0 |
求:
(1)最终生成二氧化碳的质量为 g;
(2)样品中碳酸钙的质量分数;
(3)将反应后烧杯中的剩余物质进行过滤,再向滤液中加入多少克水可以得到5%的氯化钙溶液?